Россия
Россия
УДК 551.462.32 Материковый шельф. Островной шельф
УДК 292 Религии в Древней Греции и Древнем Риме. Классическая мифология
В последние десятилетия возрос интерес к полихетам семейства Dorvilleidae, приспособленным к существованию в маргинальных биотопах – в холодных метановых сипах, гидротермальных источниках, сульфидных осадках. Целью настоящей работы являлся анализ экологических особенностей, распространения и количественной представленности Dorvilleidae в Черном море. Материалом для исследований послу-жили сборы макрозообентоса на Черноморском шельфе в 2010–2019 гг., выполнен-ные с помощью дночерпателя «Океан-50» (S = 0.25 м2), а также сборы бентоса в прибрежных районах Крыма в 1997–2023 гг. с использованием водолазного дночерпа-теля (S = 0.04 м2). В северной части Черного моря зарегистрированы три представителя Dorvilleidae: Dorvillea rubrovittata (Grube, 1855), Schistomeringos rudolphii (Delle Chiaje, 1828), Protodorvillea kefersteini (McIntosh, 1869). Батиметрический диапазон их обитания ограничивается фотической зоной (до 50 м). D. rubrovittata встречался преимущественно в биотопе обрастания твердых субстратов, относительно большие скопления (до 438 экз.·м–2) образовывал в подводных каналах и гротах. Вид впервые обнаружен нами в северо-западной части Черного моря. S. rudolphii зарегистрирован в небольших количествах (2–300 экз.·м–2) вдоль всего побережья Крыма. Этот вид встречался преимущественно на ракушечных грунтах и среди макрофитов. P. kefersteini отмечен почти во всей северной части Черного моря (за исключением кавказских берегов) на песчано-ракушечных грунтах с разной степенью заиления. Это массовый вид, его плотность в отдельных районах достигала значительных величин. В бухте Круглой (район Севастополя) в течение длительного времени регистрировали устойчивую популяцию этого вида с наиболее высокими показателями встречаемости (до 88 %) и плотности (до 13 215 экз..м–2). Предполагаемая причина этого – образование в бухте Круглой больших скоплений бактерий и микроводорослей, которые являются кормовой базой для P. kefersteini.
Polychaeta, Dorvilleidae, Protodorvillea kefersteini, бухта Круглая, Черное море
Введение
Многощетинковые черви семейства Dorvilleidae довольно широко распространены в Мировом океане. В 1970-х гг. было известно восемь родов этого семейства [1]. Дальнейшие исследования экосистем, в том числе глубоководных, в зонах гидротермальных, метановых и других сипов привели к обнаружению многих новых представителей Dorvilleidae, приспособленных к существованию в этих маргинальных биотопах. Оказалось, что дорвиллеиды даже доминируют среди полихет макрозообентоса в холодных метановых сипах, гидротермальных источниках, в скоплениях китовых костей, в осадках зоны кислородного минимума [2]. Дорвиллеиды демонстрируют необычную толерантность к сульфидам. Полихеты этого семейства обнаружены в сульфидных осадках мелководных районов, а также в загрязненных эстуариях [2–4]. Представители Dorvilleidae считаются оппортунистическими видами, способными колонизировать различные местообитания, обогащенные органическими веществами и тяжелыми металлами [2]. Отмечено, что некоторые виды дорвиллеид образуют большие скопления в районах интенсивной аквакультуры рыб, также численность их увеличивается вблизи мидийных ферм. С учетом этого возможно их использование в качестве индикаторов воздействия аквакультуры на окружающую биоту
К настоящему времени описано уже более 200 видов, относящихся к 31 ро-
ду Dorvilleidae. В Черном море из семейства Dorvilleidae известны представители трех родов [6–8]. Это Protodorvillea kefersteini (McIntosh, 1869), Dorvillea rubrovittata (Grube, 1855), Schistomeringos rudolphii (Delle Chiaje, 1828) и Schistomeringos neglecta (Fauvel, 1923). Последний вид указан для прибосфорского района и берегов Болгарии и, видимо, относится к комплексу видов, обитающих в зоне действия вод Мраморного моря ) [9]. Первые три вида указаны для многих районов Черного моря ) [9–13], однако данных об их распределении и встречаемости в различных биотопах крайне мало. В Азовском море представители Dorvilleidae не зарегистрированы [8, 14, 15].
С учетом возросшего интереса к этому семейству полихет актуальным становится более детальный анализ экологических особенностей, распространения и количественной представленности Dorvilleidae в Черном море, что и является целью настоящей работы.
Материалы и методы
Материалом для наших исследований послужили сборы макрозообентоса из экспедиций НИС «Профессор Водяницкий» (рейсы № 64, 68, 70, 72, 75, 84, 86, 90, 96, 108) в 2010–2019 гг. Работы проведены на шельфе северной части Черного моря от берегов Румынии до Кавказского побережья (район Туапсе), а также в Азовском море у берегов Крыма. Станции выполнены в диапазоне глубин от 10 до 137 м. Соленость воды в Черном море колебалась в пределах 16.89–18.47 ‰, в Азовском море во время отбора проб она изменялась от 12.53 до 15.22 ‰. Использованы материалы дночерпательных проб, собранных с 291 станции. Отбор донных осадков осуществляли с помощью дночерпателя «Океан-50» (площадь захвата 0.25 м2). Грунт промывали через сита с наи-
меньшим диаметром 1 мм.
При анализе также использованы материалы бентосных съемок, выполненных в прибрежных районах Крыма отделом экологии бентоса ИнБЮМ в период с 1997 по 2023 г. Исследования проводили в Каркинитском заливе, оз. Донузлав, бухтах Севастополя, в акватории Карадага, Феодосийском заливе, а также в некоторых подводных пещерах естественного и искусственного происхождения в Юго-Восточном и Юго-Западном Крыму [16]. В 2005 г. в западной части б. Круглой были проведены круглогодичные исследования макрозообентоса на двух станциях (глубина 6–7.5 м). Пробы с рыхлых грунтов отбирали ручным водолазным дночерпателем (S = 0.04 м2), как правило, в двух повторностях. С твердых поверхностей материал собирали с помощью рамки (S = 0.04 м2) с пришитым к ней мешком из мельничного газа. Выполнено более 440 станций в диапазоне глубин 0–25 м. Собранный материал промывали через сита с диаметром ячеи 0.5 мм. Фиксация всех образцов выполнена в 4%-ном нейтрализованном формалине. При таксономической иден-
тификации полихет использовали литературные данные [7].
Результаты и обсуждение
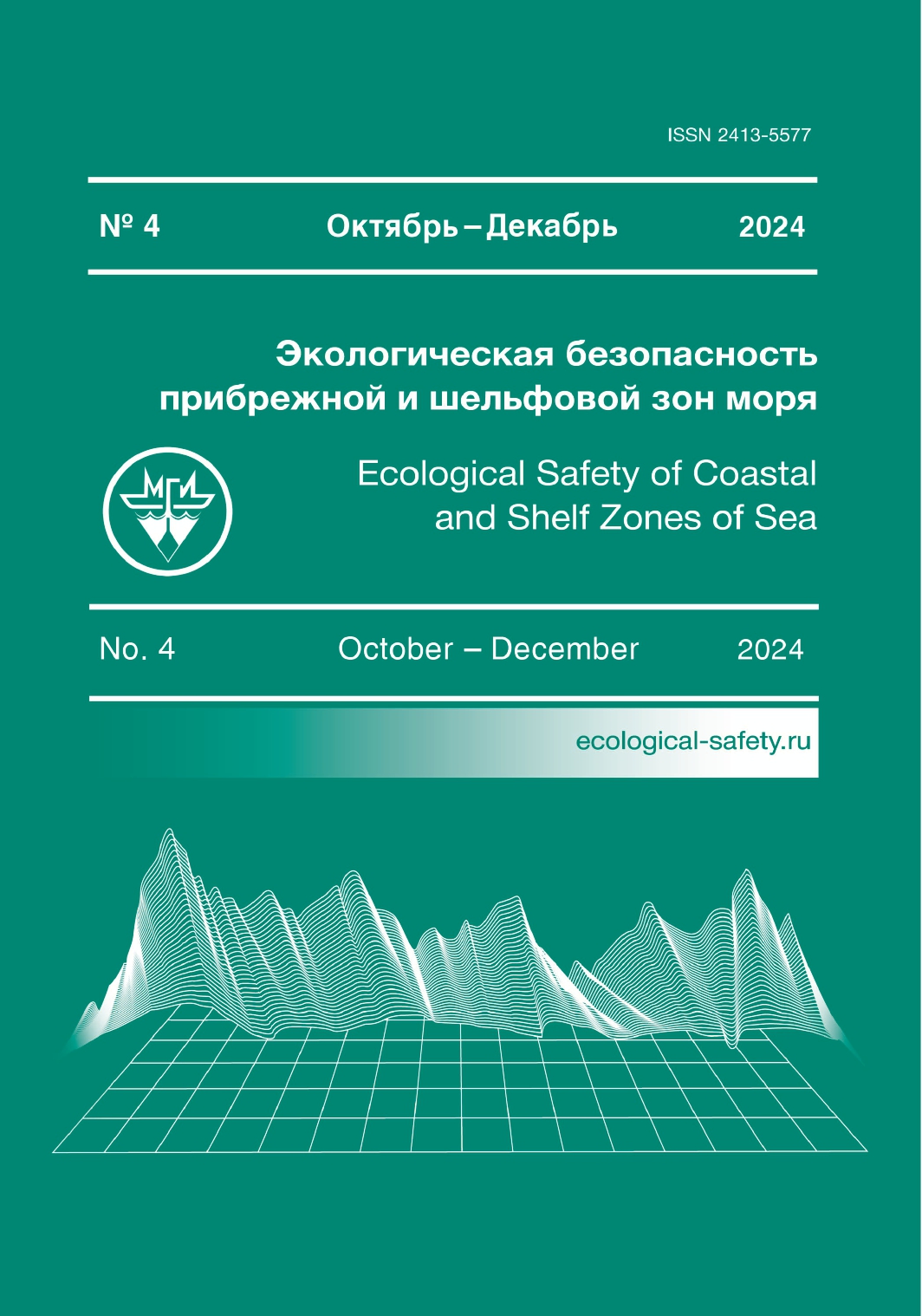
За время исследований в рейсовых материалах (на рыхлых грунтах на глубине более 10 м) дорвиллеиды обнаружены на 52 из 291 станции, которые были выполнены в Черном море. В Азовском море (21 станция) дорвиллеиды не зарегистрированы. При этом P. kefersteini зарегистрирована на 30 станциях, S. rudolphii – на 19, а D. rubrovittata – на трех (рис. 1). Таким образом, на рыхлых грунтах открытых частей моря дорвиллеиды – относительно редкие виды, лишь у P. kefersteini встречаемость была 10 %, у S. rudolphii и D. rubrovittata она составляла соответственно 6.5 и 1 %. Максимальная плотность дорвиллеид достигала 704 экз.·м−2.
В прибрежье Крыма (глубина 1–22 м) дорвиллеиды встречались почти во всех районах на рыхлых грунтах и в обрастании (рис. 1). Их плотность колебалась в больших пределах, в целом она была намного выше, чем в открытых районах моря. Представители этого семейства обнаружены также в подводных пещерах и каналах.
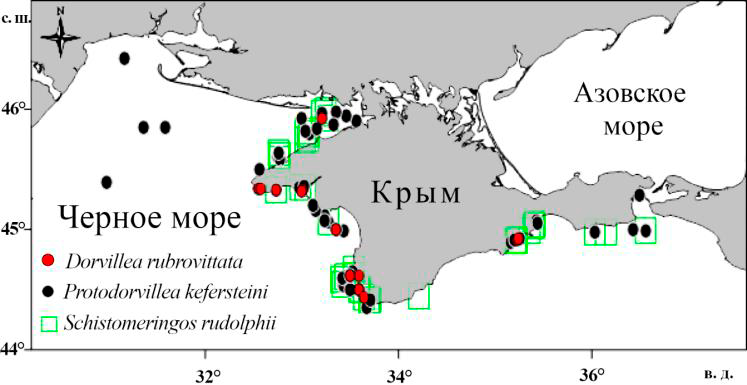
Рис. 1. Распространение Dorvilleidae в северной части Черного моря
Fig. 1. Distribution of Dorvilleidae in the northern part of the Black Sea
Dorvillea rubrovittata
D. rubrovittata – атланто-средиземноморский вид [1, 7, 17], в Черном море указан для прибосфорского района, берегов Турции и Болгарии [7, 9], а также найден у берегов Кавказа и Крыма [7, 18, 19]. Относительно редкий вид, отмечен в небольшом количестве на ракушечнике, в обрастании скал и камней на глубине 0–50 м 5) [7, 9]. Не зарегистрирован у берегов Румынии [10] и в целом в северо-западной части Черного моря (СЗЧМ) 4) [20, 21].
В наших сборах D. rubrovittata (рис. 2, а) в открытых районах моря обнаружен только у западных берегов Крыма и в Каркинитском заливе на глубине 14–30 м на ракушечном грунте. Его плотность составляла 4–16 экз.·м−2 (рис. 1).
В прибрежной мелководной зоне вид зарегистрирован в обрастаниях скал и камней в районах Карадага, Тарханкута, Донузлава. В Севастопольских бухтах он встречался в обрастании садков устричных ферм [22]. В этих биотопах его численность не превышала 13 экз.·м−2. Более высокие значения плотности D. rubrovittata отмечены на стенках подводных пещер в районах Балаклавы

Рис. 2. Dorvillea rubrovittata (a); Protodorvillea kefersteini (b)
Fig. 2. Dorvillea rubrovittata (a); Protodorvillea kefersteini (b)
и Карадага (до 125 экз.·м−2 на глубине 2 м). В подземном Балаклавском канале в обрастании бетонных стен на глубине 2 м отмечены максимальные значения этого показателя – до 438 экз.·м−2. Условия в канале отличаются от других биотопов слабой гидродинамикой и низкой освещенностью.
Таким образом, D. rubrovittata является вполне обычным видом, обитающим вдоль черноморских берегов Крыма. Вид зарегистрирован преимущественно в биотопе обрастания твердых субстратов, при этом относительно большие скопления он образует в местах с пониженной гидродинамикой.
Schistomeringos rudolphii
S. rudolphii широко распространен в Атлантическом океане (побережье Европы и Америки), Средиземном море, а также указан для некоторых районов Тихого и Индийского океанов [1, 7, 9, 17]. В Черном море известны единичные находки этого вида. Он отмечен в прибосфорском районе 2), у берегов Турции, Болгарии [8–10, 13]. Для берегов Кавказа имеется два указания о нахождении S. rudolphii [11, 15]. У берегов Крыма вид был найден только в б. Севастопольской на песчано-ракушечных грунтах среди корней зостеры 6), ). Следующая находка S. rudolphi была зарегистрирована также в районе Севастополя в конце XX в. [23]. Первые данные о регистрации этого вида в северо-западной части Черного моря относятся к концу XX – началу XXI в., когда он был обнаружен 4) в мелководных участках Ягорлыцкого, Тендровского и Каркинитского заливов [12].
В наших материалах в открытых районах моря на рыхлых грунтах S. rudolphii зарегистрирован вдоль всего побережья Крыма (рис. 1). Вид найден на глубине 10–45 м, одна находка – на глубине 88 м. Максимальные значения плотности отмечены в Каркинитском заливе (240 экз.·м−2) и Керченском предпроливье (210 экз.·м−2) на глубине 20 и 34 м соответственно.
В прибрежных сборах S. rudolphii обнаружен на глубине 2–22 м на некоторых станциях у восточного и южного берегов Крыма (Феодосийский залив, район Карадага, б. Ласпи), во многих бухтах Юго-Западного Крыма, а также в оз. Донузлав. Плотность этих полихет была относительно невелика, но иногда достигала 300 экз.·м−2 (б. Ласпи, глубина 13 м) [24]. Вид был обнаружен на различных субстратах, однако наиболее часто он встречался на ракушечных грунтах и среди макрофитов (рис. 3).
Необходимо отметить, что в Донузлаве и б. Круглой S. rudolphii обитает среди зарослей харовых водорослей, морских трав рдеста и зостеры, произрастающих на заиленных грунтах на глубине 2–7 м. Также вид в небольшом количестве (8–50 экз.·м−2) обнаружен в обрастании стен гротов и подземного Балаклавского канала.
Protodorvillea kefersteini
P. kefersteini – атланто-средиземноморский вид, указан у берегов Северной Америки, Европы, широко распространен в морях Средиземноморского бассейна [1, 9, 17]. Зарегистрирован почти во всех районах Черного моря [7–10, 13]. Однако в СЗЧМ почти до начала XXI в. P. kefersteini не встречался [20].
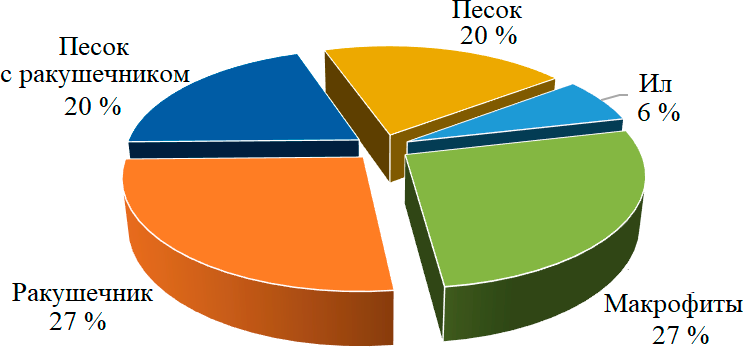
Рис. 3. Встречаемость Schistomeringos rudolphii на различных грунтах
Fig. 3. Occurrence of Schistomeringos rudolphii on different sediments
Первое обнаружение этого вида относится к псевдомейобентосу Ягорлыцкого залива [12]. В последующие годы P. kefersteini был обнаружен в мелководных районах Тендровского и Каркинитского заливов, при этом в других райо-
нах СЗЧМ он зарегистрирован не был 4) [25]. Вполне вероятно, что вид обитает у берегов Кавказа, его нахождение известно у побережья Таманского п-ова [26]. В отдельных прибрежных районах Крыма, а также у берегов Болгарии P. kefersteini указан как массовый вид, достигающий высоких показателей численности [6, 7].
В открытых районах моря мы встречали P. kefersteini (рис. 2, b) почти во всей северной части Черного моря, за исключением кавказских берегов (рис. 1). Вид зарегистрирован на глубине 12–45 м, и лишь одна находка у Южного берега Крыма была на глубине 94 м. P. kefersteini обнаружен преимущественно на песчано-ракушечных, иногда заиленных грунтах, его плотность была относительно невелика и изменялась от 4 до 464 экз..м−2.
В прибрежной мелководной зоне Крыма вид зарегистрирован в большинстве исследованных районов у восточного и южного берегов (Керченское пред-
проливье, Феодосийский залив, акватория Карадага, б. Ласпи), у Юго-Запад-
ного Крыма, а также в Каркинитском заливе и озере Донузлав. P. kefersteini отмечен на глубине 1–17 м на песчано-ракушечных грунтах с разной степенью заиления. Его плотность колебалась в больших пределах и в отдельных районах достигала значительных величин – 1200 экз..м−2 (б. Ласпи, глубина 13 м, песчано-ракушечный грунт), 4975 экз.·м−2 (акватория Карадага, район экспериментальной мидийной фермы, глубина 7 м, заиленный песок).
У берегов Юго-Западного Крыма P. kefersteini отмечен во всех исследованных бухтах и заливах, в период летних съемок его встречаемость и средняя плотность в разных районах существенно различались (таблица).
В перечисленных районах встречаемость P. kefersteini в основном не превышала 50 %, в б. Казачьей она составляла 50 % при относительно низкой средней плотности 62 экз.·м−2. Исключением была б. Круглая, где встречаемость составляла 88 %, а средняя плотность – 2514 экз.·м−2. При этом максимальная плотность вида (13 215 экз.·м−2) была отмечена летом 2004 г. (глубина 4 м, грунт – крупный песок). В работах, выполненных в бухте в 1990 г., также были
Количественные показатели распространения P. kefersteini в прибрежных районах Юго-Западного Крыма
Quantitative parameters of P. kefersteini distribution at coastal areas of southwestern Crimea
|
Район исследования / |
Встречаемость, % / |
Средняя плотность, экз.·м−2 / Mean density, ind.·м−2 |
|
Б. Балаклавская / |
18 |
10 |
|
Б. Севастопольская / |
6 |
4 |
|
Б. Круглая / |
88 |
2514 |
|
Б. Стрелецкая / |
9 |
233 |
|
Б. Казачья / |
50 |
62 |
|
М. Фиолент / |
33 |
217 |
|
Прибрежье |
10 |
76 |
|
Оз. Донузлав / |
24 |
9 |
зарегистрированы относительно высокие показатели P. kefersteini – встречаемость 40 %, средняя плотность – 280 экз.·м−2 [27]. По нашим данным, полученным в 2013 г. в б. Круглой, максимальная плотность вида в мае составляла 11 288 экз.·м−2, а в ноябре достигала 13 375 экз.·м−2 (глубина на станциях отбора проб 5–6 м, грунт – крупный песок), при этом средняя плотность составляла 2893 экз.·м−2.
Таким образом, в б. Круглой популяцию P. kefersteini регистрировали на протяжении многих лет, и она всегда характеризовалась высокой плотностью. Вероятно, большая численность этого вида во время летних съемок связана с пополнением популяции молодью. Предполагается, что размножение P. kefersteini в Черном море происходит в летний сезон, так как половозрелые особи были найдены в июне [7]. Проведенные в 2005 г. сезонные исследования в б. Круглой показали, что вид присутствует в бентосе в течение всего года в значительном количестве, достигая максимума в июле (рис. 4).
Высокие показатели плотности этого вида известны и для некоторых других районов Черного моря. У берегов Таманского п-ова средняя плотность P. kefersteini составляла 320 экз.·м−2 [26], в районе Карадага – 445 экз.·м−2, при этом максимальная достигала 2000 экз.·м−2 [7]. У Болгарского побережья
Рис. 4. Сезонная динамика плотности P. kefersteini в б. Круглой (2005 г.)
Fig. 4. Seasonal dynamics of P. kefersteini density in Kruglaya Bay (2005)
P. kefersteini указан как массовый вид, в отдельных биоценозах его средняя плотность составляла 556 экз.·м−2, а максимальная достигала 6200 экз.·м−2 [6].
Таким образом, популяция P. kefersteini в б. Круглой в течение длительного времени отличалась исключительно высокими количественными показателями по сравнению со всеми другими исследованными районами. Возникает вопрос о причинах этого явления. Можно предположить следующее.
P. kefersteini относится к мелким видам семейства Dorvilleidae, для которых характерно питание микроводорослями и бактериальной пленкой, что возможно благодаря особенностям строения их ротового аппарата [4]. Можно предположить, что в б. Круглой обеспеченность пищей этого вида чрезвычайно велика.
Бухта Круглая находится в черте Севастополя и испытывает высокую рекреационную нагрузку. В летне-осенний сезон в морской воде здесь зарегистрированы высокие концентрации органического азота и фосфора, а также нитратов, что подтверждено многолетними данными [28]. Исследования показали, что содержание аммонийного азота в донных осадках б. Круглой примерно в 10 раз выше, чем в осадках открытого моря [27]. Можно предположить, что высокая степень органического загрязнения б. Круглой способствует увеличению кормовой базы полихет и является одной из причин массового развития P. kefersteini в этой акватории.
Необходимо также отметить, что севастопольские бухты характеризуются наличием струйных газовыделений (холодных газовых сипов), обусловленных поступлением метана из глубинных слоев осадков в поверхностные горизонты грунтов. Сипы в этом районе были зарегистрированы на малых глубинах (от 11–12 м) [29]. Было показано, что в районе выхода струйных газовыделений развивались сообщества метанотрофных микроорганизмов, фор-
мирующих бактериальные маты [30]. Есть наблюдения, свидетельствующие
о наличии струйных газовыделений в районе б. Круглой [31]. В других районах Мирового океана исследования фауны метановых сипов показали, что в этих биотопах обычно присутствуют дорвиллеиды, а в бактериальных матах, формирующихся вокруг сипов, их численность особенно велика и составляет до 92 % всей макрофауны [3, 32]. Имеются данные, что у некоторых представителей семейства Dorvilleidae в рацион входят хемосинтезирующие бактерии [4]. Предполагается, что обнаруженные вокруг метановых сипов скопления дорвиллеид могут быть обусловлены пищевой специализацией этих полихет на определенных прокариотах [2, 3]. Если предположить, что вокруг струйных газовыделений в б. Круглой образуются бактериальные маты и они составляют основу питания P. kefersteini, то следствием этого и является развитие устойчивой популяции вида в данной акватории.
Заключение
В период исследований в северной части Черного моря зарегистрированы три вида семейства Dorvilleidae: Dorvillea rubrovittata (Grube, 1855), Schistome-
ringos rudolphii (Delle Chiaje, 1828), Protodorvillea kefersteini (McIntosh, 1869). Все перечисленные виды достаточно широко распространены, однако батиметрический диапазон их обитания ограничивается фотической зоной (в среднем до 50 м), что может быть связано с их питанием микро- и макрофитами. Полученные данные позволяют предположить, что на распространение дорвиллеид в Азово-Черноморском бассейне влияет также соленость воды. Вероятно, соленость 17–18 ‰, характерная в среднем для Черного моря, является для них лимитирующей – ни один вид дорвиллеид до сих пор не был обнаружен в Азовском море, несмотря на современное повышение его солености (до 15 ‰) и понтизацию фауны. Может быть, в связи с этим они крайне редки и в СЗЧМ, где в прибрежных районах возможно распреснение вод.
D. rubrovittata – обычный вид у черноморских берегов Крыма. Встречается преимущественно в биотопе обрастания твердых субстратов, относительно большие скопления образует в местах со слабой гидродинамикой и низкой освещенностью (в подводных каналах и гротах), где его плотность достигала 438 экз.·м−2. Нами D. rubrovittata впервые обнаружен в северо-западной части Черного моря.
S. rudolphii в Черном море ранее встречался редко: были известны лишь единичные находки. В наших сборах он был зарегистрирован в небольших количествах (2–300 экз.·м-2) на рыхлых грунтах вдоль всего побережья Крыма. Наиболее часто этот вид встречался на ракушечных грунтах и среди макрофитов. Отмечено, что в озере Донузлав S. rudolphii распространен в зарослях харовых водорослей и морских трав рдеста и зостеры.
P. kefersteini был встречен нами почти во всей северной части Черного моря (за исключением кавказских берегов) на песчано-ракушечных грунтах с разной степенью заиления. Это массовый вид, его плотность колебалась в больших пределах и в отдельных районах достигала высоких значений, особенно у берегов Юго-Западного Крыма, где P. kefersteini отмечен во всех исследованных бухтах и заливах. В б. Круглой в течение длительного времени регистрировали устойчивую популяцию этого вида с наиболее высокими показателями встречаемости (до 88 %) и плотности (средняя – до 2514 экз.·м−2, максимальная – 13 215 экз.·м−2). Особенностями б. Круглой являются повышенный уровень органического загрязнения и наличие струйных газовыделений, вокруг которых могут образовываться бактериальные маты. Возможно, это и приводит к образованию больших скоплений бактерий и микроводорослей, которые являются кормовой базой для P. kefersteini.
1. Jumars P. A. A generic revision of the Dorvilleidae (Polychaeta), with six new species from the deep North Pacific // Zoological Journal of the Linnean Society. 1974. Vol. 54. P. 101–135. https://doi.org/10.1111/j.1096-3642.1974.tb00794.x
2. Ecological release and niche partitioning under stress: Lessons from dorvilleid poly-chaetes in sulfidic sediments at methane seeps / L. A. Levin [et al.] // Deep Sea Research Part II: Topical Studies in Oceanography. 2013. Vol. 92. P. 214–233. https://doi.org/10.1016/j.dsr2.2013.02.006
3. Spatial heterogeneity of macrofauna at northern California methane seeps: influence of sulfide concentration and fluid flow / L. A. Levin [et al.] // Marine Ecology Progress Series. 2003. Vol. 265. P. 123–139. https://doi.org/10.3354/meps265123
4. Jumars P. A., Dorgan K. M., Lindsay S. M. Diet of worms emended: an update of pol-ychaete feeding guilds // Annual Review of Marine Science. 2015. Vol. 7. P. 497–520. https://doi.org/10.1146/annurev-marine-010814-020007
5. Paxton H., Davey A. A new species of Ophryotrocha (Annelida: Dorvilleidae) associat-ed with fish farming at Macquarie Harbour, Tasmania, Australia // Zootaxa. 2010. Vol. 2509. P. 53–61. https://doi.org/10.5281/zenodo.196027
6. Маринов Т. М. Зообентосът от българския сектор на Черно море. София : Изд. Бълг. АН, 1990. 195 с.
7. Киселёва М. И. Многощетинковые черви (РоІусhаеtа) Чёрного и Азовского мо-рей. Апатиты : Изд-во Кольского научного центра РАН, 2004. 409 с. URL: https://repository.marine-research.ru/handle/299011/5647 (дата обращения: 21.11.2024).
8. Kurt Şahin, G., Çinar M. E. A check-list of polychaete species (Annelida: Polychaeta) from the Black Sea // Journal of the Black Sea / Mediterranean Environment. 2012. Vol. 18, no. 1. P. 10–48. URL: https://www.researchgate.net/publication/251572749_ A_check-list_of_polychaete_species_Annelida_Polychaeta_from_the_Black_Sea (дата обращения: 21.11.2024).
9. Маринов Т. M. Многочетинести червеи (Polychaeta) // Фауна на България. София : Изд-во Бълг. АН, 1977. Т. 6. 258 с.
10. Surugiu V. Inventory of inshore polychaetes from romanian coast (Black Sea) // Med-iterranean Marine Science. 2005. Vol. 6, no. 1. P. 51–73. https://doi.org/10.12681/mms.193
11. Фроленко Л. Н. Характеристика зообентоса северо-восточной части Черного моря в современный период // Основные проблемы рыбного хозяйства и охраны рыбохозяйственных водоемов Азово-Черноморского бассейна : сб. научн. тр. (2006–2007 гг.). Ростов н/Д : Изд-во АзНИИРХ, 2008. С. 180–188.
12. Воробьева Л. В. Мейобентос украинского шельфа Черного и Азовского морей. Киев : Наукова думка, 1999. 300 с.
13. Çinar M. E., Erdoğan-Dereli D. Polychaetes (Annelida: Polychaeta) off Kıyıköy (Black Sea, Türkiye) with descriptions of three new species // Zootaxa. 2023. Vol. 5383, no. 4. P. 537–560. https://doi.org/10.11646/zootaxa.5383.4.6
14. Фауна водных и прибрежно-водных экосистем Азово-Черноморского бассейна / С. П. Воловик [и др.]. Краснодар : ФГУП «АзНИИРХ», 2010. 251 с.
15. Киселева М. И. Бентос рыхлых грунтов Черного моря. Киев : Наукова думка, 1981. 165 с. URL: https://repository.marine-research.ru/items/18a45e11-1f8b-4ddc-937d-42f68b777b42 (дата обращения: 21.11.2024).
16. First researches of the underwater ecosystem communities of an underground channel built in 1950s (Balaklava bay, Sevastopol) / N. G. Sergeeva [et al.] // Ecologica Mon-tenegrina. 2021. Vol. 39. P. 30–45. https://doi.org/10.37828/em.2021.39.4
17. Dauvin J.-C., Dewarumez J.-M., Gentil F. Liste actualisée des espèces d’Annélides Pol-ychètes présentes en Manche // Cahiers de Biologie Marine. 2003. Vol. 44. P. 67–95.
18. Виноградов К. А. К фауне кольчатых червей (Polychaeta) Черного моря // Труды Карадагской биологической станции. 1949. Вып. 8. С. 3–84. https://repository.marine-research.ru/handle/299011/6859 (дата обращения: 21.11.2024).
19. Миловидова Н. Ю. Донные биоценозы Новороссийской бухты // Распределение бентоса и биология донных животных в южных морях. Киев : Наукова думка, 1966. С. 75–89. URL: https://repository.marine-research.ru/handle/299011/158 (дата обращения: 21.11.2024).
20. Виноградов К. А., Лосовская Г. В., Каминская Л. Д. Краткий обзор видового со-става беспозвоночных северо-западной части Черного моря (по систематиче-ским группам) // Биология северо-западной части Черного моря. Киев : Наукова думка, 1967. С. 177–201. URL: https://repository.marine-research.ru/handle/299011/1107 (дата обращения: 21.11.2024).
21. Ковалишина С. П., Качалов О. Г. Макрозообентос филлофорного поля Зернова в мае–июне 2012 г. // Наукові записки Тернопільського національного педагогіч-ного університету імені Володимира Гнатюка. Серія: біологія. 2015. № 3–4 (64). С. 309–313.
22. Лисицкая Е. В., Болтачева Н. А. Таксономический состав многощетинковых чер-вей района мидийно-устричной фермы (Черное море, Севастополь) // Экологиче-ская безопасность прибрежной и шельфовой зон моря. 2023. № 1. С. 113–123. EDN QQGUXI.
23. Киселева М. И. Характеристика многолетних изменений бентоса в прибрежной зоне района Севастополя // Экология моря. 1988. Вып. 28. С. 26–32. EDN YICDZH.
24. Ревков Н. К., Болтачева Н. А. Восстановление биоценоза черноморского гребеш-ка Flexopecten glaber (Bivalvia: Pectinidae) у берегов Крыма (район Ласпи) // Экологическая безопасность прибрежной и шельфовой зон моря. 2022. № 4. С. 90–103. EDN WQVQWD.
25. Bondarenko, O., Vorobyova, L. Influence the north-western part of the Black Sea hab-itat factors on the meiobenthic polychaetes // Turkish Journal of Fisheries and Aquatic Sciences. 2023. Vol. 23, iss. 9. TRJFAS22222. https://doi.org/10.4194/TRJFAS22222
26. Терентьев А. С., Сёмик А. М. Макрозообентос косы Тузла (Керченский пролив) в летний период 2013 года // Экосистемы. 2019. Вып. 20. С. 82–91. EDN GDPPIS.
27. Донная фауна бухты Круглой (Черное море, Крым). Сообщ. II. Таксономический состав и количественное развитие макрозообентоса рыхлых грунтов / Н. А. Бол-тачева [и др.] // Труды Карадагской научной станции им. Т. И. Вяземского – природного заповедника РАН. 2022. Т. 7, № 2. С. 3–22. EDN QNKKEY.
28. Павлова Е. В., Мурина В. В., Куфтаркова Е. А. Гидрохимические и биологические исследования в бухте Омега (Черное море, Севастопольский шельф) // Экологическая безопасность прибрежной и шельфовой зон и комплексное использование ресурсов шельфа. Севастополь : ЭКОСИ-Гидрофизика, 2001. Вып. 2. С. 159–176. EDN EBESUV.
29. Егоров В. Н., Артемов Ю. Г., Гулин С. Б. Метановые сипы в Черном море –средообразующая и экологическая роль / Под ред. Г. Г. Поликарпова. Севастополь : ЭКОСИ Гидрофизика, 2011. 405 с. EDN MXGBHE.
30. Биогеохимические характеристики распределения метана в воде и донных осадках в местах струйных газовыделений в акватории севастопольских бухт / В. Н. Егоров [и др.] // Морской экологический журнал. 2012. Т. 11, № 3. С. 41–52. EDN TPUBEZ.
31. Струйные газовыделения в акватории внешнего рейда г. Севастополя / В. Н. Егоров [и др.] // Наукові записки Тернопільського національного педагогічного університету ім. Володимира Гнатюка. Серiя: Біологія. 2005. № 4. С. 80–82. EDN ZVRTTX.
32. Levin L. A. Ecology of cold seep sediments: interactions of fauna with flow, chemistry and microbes // Oceanography and Marine Biology. CRC Press, 2005. Vol. 43. Р. 1–46.