Севастополь, Россия
Севастополь, Россия
Россия
Россия
Рассмотрена динамика параметров карбонатной системы в период весенне-летнего «цветения» кокколитофорид с использованием данных о температуре и солености, параметров карбонатной системы (СО2, рН и щелочности) и показателя рассеяния назад взвесью (bbp(550), м‒1) для поверхностного слоя вод в северной части Черного моря в 127-м и 131-м рейсах НИС «Профессор Водяницкий». В исследуемые периоды (июнь 2023 г., май – июнь 2024 г.) концентрации кокколитофорид превышали 1.00 млн кл/л, также отмечено высокое значение рСО2 (среднее 486 ± 18 мкатм). Поверхностный слой вод был пересыщен СО2 по сравнению с атмосферой, среднее пересыщение вод СО2 составило 14 % (58 мкатм). Однако выявлено отсутствие вы-раженной связи между концентрациями кокколитов и величинами рСО2, рН и щелоч-ности, что может указывать на неосновной вклад «цветения» в концентрации СО2 в поверхностном слое вод. Установлено, что даже в период «цветения» кокколитофо-рид ключевым фактором, определяющим величину рСО2 поверхностного слоя вод, является температура воды. При этом пространственное распределение концентра-ции взвеси, представленной кокколитами, определялось динамикой вод и структурой течений в Черном море.
карбонатная система, парциальное давление углекислого газа, кокколитофориды, Черное море
Введение
Непрерывный рост содержания СО2 в атмосфере и дальнейшее его погло- щение водами океана – одного из основных естественных стоков СО2 – при- вели к снижению буферной емкости вод и изменению гидрохимических харак- теристик вод Мирового океана. В частности, наблюдается рост концентрации ионов водорода в морской воде [1]. По данным [2–4], за последние 250 лет по- казатель рН поверхностных вод океана снизился примерно на 0.11, что соот- ветствует увеличению концентрации ионов водорода на 30–40 %. Кроме того,
в водах Мирового океана отмечается снижение концентраций кислорода и раз- витие зон его дефицита [5, 6]. При этом рост концентраций СО2 в воде и атмо- сфере, а также изменение гидрохимических характеристик океана оказывают негативное воздействие на биологические организмы, в том числе имеющие в основе карбонатный скелет [2–4, 7].
В водах Мирового океана основной запас растворенного углерода пред- ставлен неорганической формой и составляет около 38 Гт С (1 Гт = 109 т) [1]. В атмосфере углерода содержится значительно меньше, и на границе поверх- ностного слоя вод и приводного слоя атмосферы формируются значительные его потоки [1, 7, 8]. Вследствие этого на границе с атмосферой, а также между поверхностным и более глубокими слоями океана происходит перераспреде- ление различных форм углерода, в том числе СО2 [2, 3], что приводит к из- менению его концентраций.
Обмен СО2 между водой и атмосферой происходит благодаря диффузии газообразного CO2 через границу раздела фаз, при этом суммарный обмен про- порционален разности парциальных давлений газообразного CO2 в воздухе и морской воде. Таким образом, он тесно связан с растворимостью CO2 в мор- ской воде (K0), которая определяет отношение содержания CO2 в морской воде к парциальному давлению CO2 в газовой фазе [5] при химическом равновесии:
K0 = [CO2]sw/pCO2, sw.
Помимо физического переноса и вклада температуры, динамика содержа- ния CO2 в поверхностном слое вод определяется не только биологическими про- цессами, но и комплексом абиотических химических реакций [2–4].
Совокупность продуктов растворения CO2 и диссоциации угольной кис- лоты образует карбонатную систему, которую можно описать системой равно- весий [1, 2, 4]:
CO2 (г.) ↔ CO2 (раств.) ↔ CO2 (раств.) + H2O ↔ H+ + HCO – ↔ 2H+ + CO 2–, (1)
Ca2+ + CO32‒ ↔ CaCO3 (тв). (2)
Ионы водорода (H+) (или рН) являются одним из основных компонентов, описывающих состояние карбонатной системы, их концентрация тесно свя- зана с концентрацией CO2; рост концентрации CO2 сопровождается ростом концентрации ионов водорода и снижением рН:
рН = −lg aH+, или условно можно принять рН ≈ −lg [H+]. (3)
Другим важным параметром карбонатной системы (не зависящим напря- мую от концентрации CO2) является общая щелочность (Alk), которая обычно определяется как превышение количества акцепторов протонов (оснований, образованных из слабых кислот) над количеством доноров протонов относи- тельно контрольной точки (формально кислотная диссоциация pKa = 4.5 при- близительно соответствует точке эквивалентности H2CO3 в морской воде). В аэробных водах океана до 96–99 % всего щелочного резерва составляет карбо- натная щелочность [9], которую можно выразить следующим соотношением:
Alk = [HCO3−] + 2[CO32−]. (4)
Карбонатная щелочность определяет буферную емкость системы, и раство- рение СО2 в воде сопровождается преимущественно смещением равновесий и изменением соотношения неорганических форм углерода, при этом содержа- ние общего растворенного неорганического углерода почти не изменяется.
Основными химико-биологическими процессами, определяющими дина- мику компонентов карбонатной системы в водной толще, являются процессы с участием органического вещества – продукция и деструкция:
6 СО2 + 6 Н2О ↔ 6 H+ + 6 HCO3‒ ↔ С6 Н12 О6 + 6 О2. (5)
а также процессы образования/растворения карбонатов:
СаСО3 + СО2 + Н2О ↔ Са2+ + 2НСО ‒. (6)
Одной из групп морского фитопланктона, вовлекающихся в процессы с участием карбонатов, являются кокколитофориды. Их клетки покрыты сло- ями пластинок – кокколитов, образованных из карбоната кальция. Самым мас- совым видом в Черном море являются клетки Emiliania huxley, их доля может достигать 99 % от общей численности кокколитофорид. Клетки этого вида мо- гут сбрасывать кокколиты, в этом случае соотношение числа кокколитов к ко- личеству клеток может достигать 400 [11, 12]. Очевидно, что, имея в основе карбонатный скелет, в период интенсивного «цветения» (когда численность кокколитофорид превышает 1 млн кл/л [13]) кокколиты влияют на оптические и тепловые характеристики поверхностных вод Мирового океана. В частности, они вызывают сильное рассеяние света, что значительно снижает прозрач- ность воды, и увеличивают альбедо водной поверхности, уменьшая тем самым инсоляцию поверхностного слоя вод [14]. Увеличение рассеяния назад приво- дит к возрастанию значений восходящей яркости моря и коэффициента ярко- сти [12]. Благодаря этому оценку численности клеток кокколитофорид и сбро- шенных кокколитов, а также концентрации карбонатов возможно проводить по дистанционным оптическим измерениям восходящей яркости [15]. Ско- рость образования карбонатов, а следовательно, и скорость связывания СО2 может как увеличиваться, так и уменьшаться в зависимости от лимитирую- щих факторов – освещенности, температуры, концентраций биогенных эле- ментов и углекислого газа [16, 17].
Таким образом, эти водоросли, вовлекаясь в цикл углерода, вносят вклад в бюджет СО2. Однако учесть все факторы и однозначно связать численность и биомассу кокколитофорид со скоростью фиксации углерода очень сложно [18]. Цель работы – оценить связь параметров карбонатной системы с «цвете- нием» кокколитофорид в поздневесенний период. Для этого в работе проана- лизирована пространственно-временна́я динамика температуры, солености, параметров карбонатной системы (СО2, рН и щелочности) и показателя рассе- яния назад взвесью (bbp(550), м‒1) для поверхностного слоя вод в северной ча-
сти Черного моря.
Материалы и методы
Данные получены в ходе 127-го (14.06.2023–07.07.2023 г.) и 131-го (27.05.2023–21.06.2024 г.) рейсов НИС «Профессор Водяницкий» в юго-вос- точной части Крымского побережья (рис. 1).

Р и с . 1 . Схема станций, на которых определяли параметры карбонатной системы и оптические ха- рактеристики. Красные кружочки – 127-й рейс НИС «Профессор Водяницкий», черные – 131-й рейс
Fig . 1 . The scheme of stations of points where the car- bonate system parameters and optical characteristics were determined. The red circles stand for stations sur- veyed in the 127th cruise of R/V Professor Vodyanitsky, the black ones stand for those surveyed in the 131st cruise
Температуру и соленость поверхностного слоя вод измеряли зондирую- щими комплексами Sea-Bird 911plus CTD или IDRONAUT OCEAN SEVEN 320 PlusM, на мелководных станциях (с глубиной менее 50 м) – гидрологическим CTD-зондом SeaSun CTD48M.
Пробы воды поверхностного слоя вод отбирали с глубины 1.5–3.0 м с помо- щью погружного насоса; забор проб воздуха выполняли на высоте 10 м над уровнем моря в отсутствие дополнительного источника СО2.
Концентрацию СО2 определяли с помощью инфракрасного анализатора LI-7000 с диапазоном концентрации СО2 0–3000 мкмоль/моль, для определе- ния концентрации СО2 в воде использовали специальный модуль (эквилибра- тор), обеспечивающий контакт анализируемой воды и воздуха для достижения равновесного рСО2 в газовой фазе.
Прибор калибровали по аргону (объемная доля СО2 = 0 мкмоль/моль) и поверочной смеси с концентрацией СО2 = 440 мкмоль/моль. Погрешность ме- тода составляет 1 % [19]. В качестве газа-носителя был использован аргон.
Величину рН измеряли с помощью иономеров И-160, И-160МП с исполь- зованием буферных растворов шкалы NBS [20]. Общую щелочность опреде- ляли методом прямого титрования с потенциометрическим окончанием, тит- руя 50 мл морской воды 0.02H 1) раствором соляной кислоты, с использова- нием высокоточной поршневой бюретки Metrohm Dosimat 765 и рН-метра Hanna HI-2215 для определения конечной точки титрования. Все измерения проводили согласно методике 2).
Данные оптических характеристик
Показатель рассеяния назад на длине волны 550 нм (bbp(550), м–1) рассчи- тывали на основе данных измерений коэффициента спектральной яркости вод- ной толщи в оптическом диапазоне при помощи полуаналитического алго- ритма [21]. Для определения коэффициента яркости использовали спектро- фотометр, разработанный в лаборатории отдела оптики и биофизики моря ФИЦ МГИ [22]. Методика измерений согласуется с протоколами NASA для подспутниковых измерений 3). Для пересчета рассеяния назад на взвеси в численность отделенных кокколитов Nc (шт/м3) использовано эмпирическое соотношение из работы [23]:
|
где bbcocc(546) – рассеяние назад на взвеси кокколитов на длине волны 546 нм. Изменениями рассеяния в пределах 5 нм в данной работе пренебрегается. При этом следует отметить, что данное соотношение получено для Чер-
ного моря в 1990-е гг. и коэффициенты в нем могут оказаться на текущий момент неподходящими. Как было показано в работе [24], даже для одного района в течение нескольких дней данные коэффициенты могут значительно изменяться, при этом характер линейной связи остается постоянным. Поэтому в данной работе концентрации взвешенных кокколитов и клеток кокколитофо- рид должны восприниматься как оценочные значения с точностью до коэффи- циента, введенные для удобства восприятия, тем более что, помимо взвеси кок- колитного происхождения, в воде находится и терригенная взвесь, точное ко- личество которой оценить сложно.
Для расчета численности клеток Nсосс (млн кл/л) использована формула из работы [25], полученная также по данным 1996–1998 гг.:
Ncocc = 160 bbp(555) − 0.32 R2 = 0.82, (8)
где bbp(555) – рассеяние назад на длине волны 555 нм.
Результаты
По результатам расчетов, в поздневесенний гидрологический сезон рассе- яние назад bbp(550) изменялось в диапазонах 0.008–0.020 м−1 (2023 г.) и 0.004–
0.021 м−1 (2024 г.), тогда как в другие сезоны для Черного моря характерны
значения 0.003–0.009 м−1 [26]. Это показывает, что как минимум половину вклада в рассеяние назад вносила взвесь кокколитного происхождения.
Рассчитанное на основе этого показателя количество кокколитов и клеток кокколитофорид (в соответствии с формулами (8) и (9) [23, 25]) приведено в табл. 1. Соотношение численности клеток и кокколитов при измеренных уровнях рассеяния составляло в среднем около 88 и 94 в 127-м и 131-м рейсах соответственно. Это означает, что в формулы уже заложено предположение о связи повышенного рассеяния назад с увеличением числа отделенных кокко- литов на клетку.
3) Ocean optics and biogeochemistry protocols for satellite ocean colour sensor validation. Vol. 3 : Protocols for satellite ocean colour data validation: in situ optical radiometry / G. Zibordi [et al.]. Dartmouth, NS, Canada : IOCCG, 2019. 67 p. http://dx.doi.org/10.25607/OBP-691
Т а б л и ц а 1 . Данные о гидролого-гидрохимических и биооптических характеристи- ках поверхностного слоя вод Черного моря в поздневесенний период
T a b l e 1 . Data of hydrological-hydrochemical and bio-optical characteristics of the Black Sea surface waters in late spring period
|
Параметр / Parameter |
127-й рейс (14.06.2023–07.07.2023)* / 127th cruise (14 June 2023–7 July 2023)* |
131-й рейс (27.05.2023–21.06.2024) / 131st cruise (27 May 2023–21 June 2024) |
||
|
Среднее / Average |
Диапазон значений / Value range |
Среднее / Average |
Диапазон значений / Value range |
|
|
Т, °С |
23.0 ± 0.8 |
20.7–24.6 |
20.2 ± 1.5 |
16.8–25.7 |
|
S, ‰ |
17.88 ± 0.11 |
17.63–18.35 |
18.38 ± 0.14 |
17.99–18.62 |
|
pCO2 sea, мкатм / pCO2 sea, µatm |
480 ± 7 |
460–501 |
498 ± 23 |
449–546 |
|
pCO2 air, мкатм / pCO2 air, µatm |
421 ± 5 |
411–441 |
435 ± 3 |
423–448 |
|
ΔpCO2, мкатм / ΔpCO2, µatm |
59 ± 9 |
36–79 |
70 ± 31 |
15–117 |
|
Ncocc, млн кл/л / Ncocc, million cells/L |
1.39 ± 0.28 |
0.87–2.95 |
1.16 ± 0.55 |
0.32–2.97 |
|
Nc ×109, шт/м3 / Nc ×109, pcs/m3 |
112 ± 19 |
82–225 |
102 ± 37 |
44–226 |
|
Alk, ммоль/л. / Alk, mmol/L |
3.224 ± 0.019 |
3.170–3.279 |
3.250 ± 0.033 |
3.137–3.296 |
|
pH |
8.30 ± 0.02 |
8.25–8.37 |
8.27 ± 0.02 |
8.23–8.32
|
В табл. 1 приведены данные об основных гидрологических характеристи- ках и параметрах карбонатной системы в поверхностном слое вод Черного моря для 127-го и 131-го рейсов НИС «Профессор Водяницкий».
Как видно из табл. 1, в исследуемый период наблюдалось «цветение» кок- колитофорид с разной степенью интенсивности, а концентрация кокколитов в среднем превышала 100·109 шт/м3. Далее в работе будет обсуждаться пара- метр концентрации кокколитов (Nc) как наиболее приближенный к реальности, поскольку оптические измерения позволяют рассчитать этот параметр напря- мую, а соотношение клеток и кокколитов зависит от стадии «цветения». В сред- нем, как отмечено выше, на одну клетку приходится около 90 частиц кокколи- тов. Кроме того, на наш взгляд, именно кокколиты должны вносить наиболь- ший вклад в концентрацию СО2 по сравнению с клетками кокколитофорид (в соответствии с уравнением (6)).
При этом во всех случаях поверхностный слой вод был пересыщен СО2 по сравнению с атмосферой (табл. 1), то есть воды являлись источником угле- кислого газа для атмосферы.
В июне 2023 г. число клеток коколитофорид достигало 2.95 млн кл/л (при среднем значении 1.39 млн кл/л), количество кокколитов составляло в среднем 112·109 шт/м3 (табл. 1). Преобладание клеток с карбонатной основой способствовало высоким значениям рСО2 (образование СО2 в соответствии с уравнением (6)) и пересыщению поверхностного слоя вод СО2 по сравнению с атмосферой. В среднем рСО2 поверхностного слоя вод составило 480 ± 7 мкатм при диапазоне изменчивости от 460 до 501 мкатм. Увеличение температуры поверхностного слоя вод (до 24.6 °С при среднем значении 23.0 ± 0.8 °С) также поддерживало высокие значения рСО2, на что указывает средний характер связи этих параметров – коэффициент корреляции рСО2 с температурой в по- верхностном слое вод равен 0.52.
На рис. 2 приведена динамика изучаемых параметров в ходе 127-го рейса. К основным трендам можно отнести увеличение температуры, рост рСО2 и снижение числа кокколит.
На рис. 3 приведено изменение параметров в конце весеннего гидроло- гического сезона 2024 г. (конец мая – июнь). В этот период также наблюда- лось «цветение» кокколитофорид – в среднем 1.16 млн кл/л при диапазоне значений 0.32–2.96 млн кл/л, количество кокколитов составило в среднем 102·109 шт/м3 (табл. 1). Как и следовало ожидать, поверхностный слой вод
также был существенно пе-
ресыщен СО2 по сравнению с атмосферой (градиент рСО2 мог достигать более 100 мкатм), и в поверхност- ных водах Черного моря наблюдались глубоко эвази- онные условия (поток СО2 направлен из воды в атмо- сферу). Среднее значение рСО2 в поверхностном слое вод составило 498 мкатм, диапазон изменения рСО2 – от 449 до 546 мкатм (10 %).
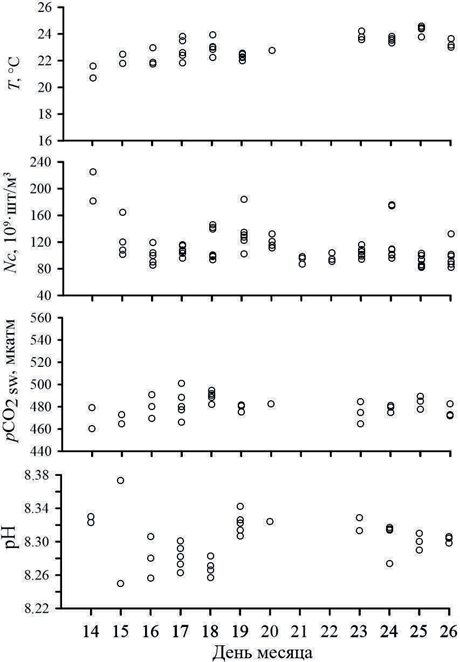
Р и с . 2 . Динамика рН, рСО2, числа кокколит и температуры поверхностного слоя вод в июне 2023 г. (127-ой рейс НИС «Про- фессор Водяницкий»)
F i g . 2 . Changes in pH, рСО2, coccoliths and temperature of the surface water layer in June 2023 (127th cruise of R/V Professor Vod- yanitsky)
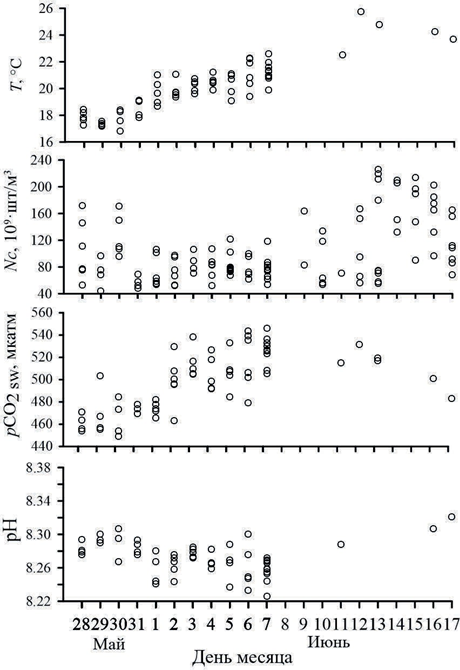
Ри с . 3 . Динамика рН, рСО2, числа кокколит и температуры поверхностного слоя вод в мае – июне 2024 г. (131-й рейс НИС
«Профессор Водяницкий»)
F i g . 3 . Dynamics of pH, рСО2, coccoliths and temperature of the surface water layer in May–June 2024 (131st cruise of R/V Profes- sor Vodyanitsky)
Температура поверхностного слоя вод достигла 20 °С, при этом с ростом температуры наблюдалось увеличение рСО2 – максимальные значе- ния рСО2 в воде соответство- вали максимальным темпера- турам поверхностного слоя вод (рис. 3). Коэффициент корреляции рСО2 и темпера- туры поверхностного слоя вод составил 0.68, что указы- вает на более существенный вклад температуры в концен- трации СО2.
Значения рН (рис. 2, 3) и щелочности в исследуемые периоды изменялись в узких пределах. Средние значения рН составили 8.30 ± 0.02 и 8.27 ± 0.02 в 2023 и 2024 гг. соответственно (табл. 1). Эти значения соответствуют данным многолетних наблюдений для данного периода.
Щелочность также мало изменялась на межгодовом масштабе –
3.224 ± 0.019 и 3.250 ± 0.033 в 2023 и 2024 гг. соответственно. При этом наблю- далась ее пространственная неоднородность, что в первую очередь было обу- словлено вкладом солености (коэффициент корреляции 0.73), а не влиянием физико-химических процессов трансформации органического вещества или
«цветением».
Обсуждение
В период весенне-летнего «цветения» фитопланктона (конец мая – июнь) основу биомассы (50–60 %) создают кокколитофориды [11, 13, 27]. Их разви- тие в этот период определяется вкладом ряда абиотических факторов: света, температуры и концентрации биогенных веществ, а также биотическим – мик- розоопланктонным выеданием [11].
В исследуемые периоды концентрации кокколитофорид (более 1.0 млн кл/л, табл. 1) указывают на их «цветение». В поверхностном слое вод также отмечено высокое рСО2 (среднее 486 ± 18 мкатм) при среднем значении 442 ± 44 мкатм (по нашим данным за 2015–2024 гг., охватывающим период с марта по декабрь).
Среднее пересыщение вод СО2 по сравнению с атмосферой составило 14 % (58 мкатм). Можно предположить, что высоким значениям рСО2 способство- вало «цветение» кокколитофорид, которое сопровождается продукцией СО2 (уравнение (6), справа налево). Кроме того, рост температуры поверхностного слоя вод (табл. 1) способствует смещению системы карбонатного равновесия в сторону накопления СО2 (уравнение (1)), а также интенсификации деструк- ции органического вещества (уравнение (5), справа налево), образованного в период весеннего «цветения» фитопланктона.
В июне 2023 г. (127-й рейс НИС «Профессор Водяницкий») среднее со- держание кокколитофорид составляло 1.39 млн кл/л, что соответствовало 112·109 шт/м3 кокколитов (табл. 1), однако в течение месяца отмечалось сни- жение количества кокколитов (см. рис. 2). Это может указывать на затухание
«цветения» и постепенное растворение карбонатов, происходящее по схеме уравнения (6) (направление слева направо). При этом процессе должно наблюдаться снижение концентрации СО2 и увеличение концентрации гид- рокарбонатов, что сопровождается увеличением рН, и, в соответствии с урав- нениями (4) и (6), должна увеличиваться щелочность. Однако ни в простран- ственном отношении, ни в сезонном ходе такой тенденции не наблюдалось: по данным многолетних наблюдений, для данного региона в отсутствие «цве- тения» кокколитофорид (март) средние значения щелочности составляют
3.281 ± 0.062 ммоль/дм3, а рН – 8.26 ± 0.09, что статистически не отличается от их поздневесенних значений (табл. 1). При этом воды значительно недо- насыщены СО2 по сравнению с атмосферой (среднее значение градиента рСО2 = −46 ± 21 мкатм). Таким образом, можно предположить, что данный биологический процесс не является определяющим ни для динамики СО2, ни для динамики других гидрохимических характеристик (рН и щелочность). Это также подтверждают данные корреляционного анализа – коэффициент корреляции рСО2 с числом кокколитов составляет −0.22, что указывает на слабый характер связи. Наиболее тесная связь рСО2 была с температурой (коэффициент корреляции 0.52) и рН (коэффициент корреляции −0.53).
В конце мая – июне 2024 г. также отмечено «цветение» кокколитофорид (1.16 млн кл/л, табл. 1), что соответствовало 102·109 шт/м3 кокколитов. По динамике исследуемых гидрохимических и биооптических параметров можно выделить два периода: 28 мая – 7 июня и 11–17 июня (рис. 3). Так, изменение числа кокколитов указывает на развитие «цветения» в течение рейса с мая по июнь. В первый период среднее число кокколитов составило (83 ± 20)·109 шт/м3, во второй – (131 ± 49)·109 шт/м3, при этом максимальные значения могли достигать 226·109 шт/м3.
В первый период на фоне роста температуры поверхностного слоя вод и отсутствия видимого тренда к увеличению числа частиц кокколитов отмеча- ется увеличение рСО2 и снижение рН поверхностного слоя вод (рис. 3). Это может свидетельствовать о начале формирования и постепенного накоп- ления кокколитов, сопровождающемся увеличением рСО2 (уравнение (6) справа налево) и снижением рН (рис. 3). Следующий период (11–17 июня) ха- рактеризуется ростом числа кокколитов, снижением рСО2 и ростом рН (рис. 3). Увеличение числа кокколитов и концентрации кокколитофорид (средняя кон- центрация в этот период составила 1.66 млн кл/л) указывает на «цветение».
Однако наблюдаемое при этом постепенное снижение рСО2 и увеличение рН, вероятнее всего, свидетельствует о наличии дополнительного фактора, способ- ствующего связыванию СО2. При этом образование коккоколит не является основным процессом, определяющим концентрацию СО2 и ионов водорода в данном случае.
Таким образом, по динамике числа кокколитов в поздневесенний период можно предположить наличие трех периодов: начало «цветения» и постепен- ное накопление кокколитофорид (конец мая – начало июня, среднее число кок- колитов 83·109 шт/м3), их накопление и вспышка «цветения» в течение июня (среднее число кокколитов 131·109 шт/м3), а затем затухание «цветения» к концу июня (среднее число кокколитов 112·109 шт/м3) с последующим разложением карбонатов (рис. 2, 3).
Мы пытались описать динамику рСО2 с точки зрения процессов, происхо- дящих с вовлечением карбонатного углерода и его трансформацией, а также изменением параметров карбонатной системы (уравнения (1), (2), (5), (6)). Однако отсутствие статистически значимой связи числа клеток кокколитофо- рид (и числа кокколитов) как с рСО2 (коэффициент корреляции −0.22 и −0.06 для 127-го и 131-го рейсов соответственно), так и с щелочностью (коэффици- ент корреляции 0.05 и 0.09 для 127-го и 131-го рейсов соответственно), а также умеренный характер их связи с величиной рН (коэффициенты корреляции 0.30 и 0.40 для 127-го и 131-го рейсов соответственно) указывает на непреоб- ладающий вклад кокколитофорид в состояние карбонатной системы и ее пара- метры.
Отсутствие связи между концентрацией кокколитофорид и величиной щелочности позволяет предположить, что изменение щелочности не связано с биологическими процессами, а определяется в первую очередь абиотическим фактором – изменением солености (коэффициент корреляции 0.86 и 0.88 для 127-го и 131-го рейсов соответственно). При этом нужно отметить неболь- шие диапазоны изменения щелочности в течение рейсов – около 4 % (статисти- чески значимыми являются изменения более 2 %) от среднего значения.
Как и следовало ожидать, в соответствии с уравнениями (1)–(5), измене- ние рН носило характер, обратный изменению рСО2, – увеличение рСО2 со- провождалось снижением рН. Наиболее явно эта зависимость была выражена в 131-м рейсе. В первый период (28.05.2024–07.06.2024) рост рСО2 составил 10 %, а снижение рН было менее выраженным в процентном соотношении, однако при этом концентрация ионов водорода (уравнение (3)) увеличилась на ⁓ 7 %. После (11.06.2024–17.06.2024) наблюдалось снижение рСО2 на 8 % и концентрации ионов водорода на 7 %. Коэффициент корреляции рН и рСО2 составил −0.53 и −0.57 для 127-го и 131-го рейсов соответственно, что указы- вает на средний характер связи и вклад абиотической составляющей в дина- мику СО2 (уравнение (1), система карбонатных равновесий).
Тем не менее в наибольшей степени проявлялся вклад температурного фактора в динамику рСО2 – коэффициенты корреляции составляют 0.52 и 0.71 для 127-го и 131-го рейсов соответственно. При этом увеличение температуры способствует как интенсификации биологических процессов, так и сдвигу рав- новесий в карбонатной системе в сторону накопления СО2.

Р и с . 4 . Пространственное распределение рСО2 (а), температуры (b) и числа кокколитов (c) в поверхностном слое вод по данным 131-го рейса (1-й этап, 28.05.2024–07.06.2024)
F i g . 4 . Spatial distribution of рСО2 (a), temperature (b) and coccoliths (c) in the surface water layer based on data from the 131st cruise (1st stage, 28 May 2024 –7 June 2024)
Вклад температуры в величину рСО2 поверхностного слоя вод также наблюдается и в пространственной изменчивости исследуемых параметров (на примере 131-го рейса) – из рис. 4 видно, что районы максимальных значе- ний рСО2 совпадают с районами повышенной температуры поверхностного слоя вод.
Распределение кокколитов качественно не совпадало с распределением рСО2 (рис. 4, а, c), что также подтверждает предположение о неосновном вкладе биотического фактора в величину рСО2 поверхностного слоя вод.
На основе расчетных данных (рис. 4, с) и данных спутниковых снимков (для примера URL: http://dvs.net.ru/mp/data/modis/2406/24062955.gif) предпо- ложено, что поля взвеси, основой которой являются преимущественно кокко- литы, формируются под действием гидродинамического фактора – водной массы, обогащенной клетками кокколитофорид и произведенным ими взве- шенным веществом, которая переносится вместе с Основным Черноморским течением из южных районов моря. В итоге образуется поле концентраций взве- шенного вещества, где более прозрачная вода прижата к берегу, а более мутная наблюдается в мористой части полигона.
Выводы
В исследуемые периоды (май – июль) в поверхностном слое вод наблюда- лось «цветение» кокколитофорид (более 100 млн кл/л,), а доля взвеси кокко- литного происхождения составляла 50 % и более. Пространственное распреде- ление концентрации взвеси, представленной кокколитами, определялось дина- микой вод и структурой течений в Черном море
Воды были пересыщены СО2 по сравнению с атмосферой, среднее рСО2 составило 486 ± 18 мкатм, что на ⁓ 20 % превышает среднегодовое значение рСО2 для данного региона.
Анализ динамики числа кокколитов в поздневесенний период позволил выделить три периода: начало «цветения» и постепенное накопление кокколи- тофорид (конец мая – начало июня, среднее число кокколитов 83·109 шт/м3), их накопление и вспышка «цветения» в течение июня (среднее число кокколи- тов 131·109 шт/м3), а затем затухание «цветения» к концу июня (среднее число кокколитов 112·109 шт/м3) с последующим разложением карбонатов.
Установлено отсутствие статистически значимой связи числа клеток кок- колитофорид (и числа кокколитов) как с рСО2 (коэффициент корреляции −0.22 и −0.06 для 127-го и 131-го рейсов соответственно), так и с щелочностью (ко- эффициент корреляции 0.05 и 0.09 для 127-го и 131-го рейсов соответственно), а также умеренный характер их связи с величиной рН (коэффициенты корре- ляции 0.30 и 0.40 для 127-го и 131-го рейсов соответственно). Отсутствие вы- раженной связи между концентрациями кокколитов и величинами рСО2, рН и щелочности позволяет предположить, что, несмотря на вклад «цветения» кокколитофорид в поддержание высоких концентраций CO₂ в верхнем слое вод, этот фактор не является основным.
В наибольшей степени вклад в динамику рСО2 вносит температурный фак- тор – коэффициенты корреляции составили 0.52 и 0.71 для 127-го и 131-го рей- сов соответственно. Это обусловлено прежде всего тем, что увеличение тем- пературы способствует как интенсификации биологических процессов, так и сдвигу равновесий в карбонатной системе в сторону накопления СО2. Таким образом, даже в период «цветения» кокколитофорид ключевым фактором, определяющим величину рСО2 поверхностного слоя вод, является темпера- тура.
1. Zeebe R. E. History of seawater carbonate chemistry, atmospheric CO2, and ocean acid- ification // Annual Review of Earth and Planetary Sciences. 2012. Vol. 40, iss. 1. Р. 141–
2. https://doi.org/10.1146/annurev-earth-042711-105521
3. Global sea–air CO2 flux based on climatological surface ocean pCO2, and seasonal biological and temperature effects / T. Takahashi [et al.] // Deep Sea Research. Part II: Topical Studies in Oceanography. 2002. Vol. 49, iss. 9–10. Р. 1601–1622. https://doi.org/10.1016/s0967-0645(02)00003-6
4. Wanninkhof R. Relationship between wind speed and gas exchange over the ocean re- visited // Limnology and Oceanography: Methods. 2014. Vol. 12, iss. 6. P. 351–362. https://doi.org/10.4319/lom.2014.12.351
5. Schulz K. G., Maher D. T. Atmospheric carbon dioxide and changing ocean chemistry // Marine Pollution – Monitoring, Management and Mitigation / Edited by A. Reichelt- Brushett. Cham : Springer, 2023. Р. 247–259. (Springer Textbooks in Earth Sciences, Geography and Environment ; vol. 11). https://doi.org/10.1007/978-3-031-10127-4_11
6. DeVries T. The ocean carbon cycle // Annual Review of Environment and Resources. 2022. Vol. 47. P. 317–341. https://doi.org/10.1146/annurev-environ-120920-111307
7. Acidification of the global surface ocean: What we have learned from observations / R. A. Feely [et al.] // Oceanography. 2023. Vol. 36, iss. 2–3. Р. 120–129. https://doi.org/10.5670/oceanog.2023.222
8. Zeebe R. E., Wolf-Gladrow D. CO2 in seawater: equilibrium, kinetics, isotopes. Am- sterdam, The Netherlands : Elsevier Science, 2001. 360 p. (Elsevier Oceanography Se- ries ; vol. 65).
9. Hypoxia causes preservation of labile organic matter and changes seafloor microbial community composition (Black Sea) / G. L. Jessen [et al.] // Science Advances. 2007. Vol. 3, iss. 2. e1601897. https://doi.org/10.1126/sciadv.1601897
10. Decline of the Black Sea oxygen inventory / A. Capet [et al.] // Biogeosciences. 2016. Vol. 13, iss. 4. P. 1287–1297. https://doi.org/10.5194/bg-13-1287-2016
11. Diaz R. J., Rosenberg R. Spreading dead zones and consequences for marine ecosystems // Science. 2008. Vol. 321, iss. 5891. Р. 926–929. https://doi.org/10.1126/science.1156401
12. Стельмах Л. В. Эколого-физиологические основы развития весеннего «цветения воды» кокколитофоридой Emiliania huxleyi в Черном море // Системы контроля окружающей среды. 2018. № 13 (33). С. 85–92. EDN YIWYJV.
13. Корчемкина Е. Н., Маньковская Е. В. Оптические характеристики вод Черного моря в районе океанографической платформы во время цветения кокколитофорид в 2012 и 2017 гг. // Фундаментальная и прикладная гидрофизика. 2020. Т. 13, № 2.С. 25–34. https://doi.org/10.7868/S2073667320020033
14. Mikaelyan A. S., Silkin V. A., Pautova L. A. Coccolithophorids in the Black Sea: Their interannual and long-term changes // Oceanology. 2011. Vol. 51, iss. 1. P. 39–48. EDN OHRAVF. https://doi.org/10.1134/S0001437011010127
15. Kopelevich Ol., Sheberstov S., Vazyulya Sv. Effect of a Coccolithophore Bloom on the Underwater Light Field and the Albedo of the Water Column // Journal of Marine Science and Engineering. 2020. Vol. 8. 456. https://doi.org/10.3390/jmse8060456
16. Hopkins J., Balch W. M. A new approach to estimating coccolithophore calcification rates from space // Journal of Geophysical Research: Biogeosciences. 2018. Vol. 123, iss. 5. P. 1447–1459. https://doi.org/10.1002/2017JG004235
17. Barcelos e Ramos J., Müller M. N., Riebesell U. Short-term response of the coccolitho- phore Emiliania huxleyi to an abrupt change in seawater carbon dioxide concentrations // Biogeosciences. 2010. Vol. 7, iss. 1. P. 177–186. https://doi.org/10.5194/bg-7-177-2010
18. Zhang Y., Gao K. Photosynthesis and calcification of the coccolithophore Emiliania hux- leyi are more sensitive to changed levels of light and CO2 under nutrient limitation // Journal of Photochemistry and Photobiology B: Biology. 2021. Vol. 217. 112145. https://doi.org/10.1016/j.jphotobiol.2021.112145
19. Environmental controls on the growth, photosynthetic and calcification rates of a Southern Hemisphere strain of the coccolithophore Emiliania huxleyi: Environmental controls on E. huxleyi physiology / Y. Feng [et al.] // Limnology and Oceanography. 2016. Vol. 62, iss. 2. P. 519–540. https://doi.org/10.1002/lno.10442
20. Хоружий Д. С. Использование приборного комплекса AS-C3 для определения пар- циального давления углекислого газа и концентрации неорганического углерода в морской воде // Экологическая безопасность прибрежной и шельфовой зон и ком- плексное использование ресурсов шельфа. 2010. Вып. 23. С. 260–272. EDN WLBMPX.
21. Современные методы гидрохимических исследований океана / Отв. ред. О. К. Бор- довский, А. М. Чернякова. Москва : ИО РАН, 1992. 201 с.
22. Определение концентрации примесей в морской воде по спектру яркости вос- ходящего излучения / М. Е. Ли [и др.] // Морской гидрофизический журнал. 2015. № 6. С. 17–33. EDN VHEWVT. https://doi.org/10.22449/0233-7584-2015-6-17-33
23. Ли М. Е., Мартынов О. В. Измеритель коэффициента яркости для подспутниковых измерений биооптических параметров вод // Экологическая безопасность при- брежной и шельфовой зон и комплексное использование ресурсов шельфа. 2000. Вып. 1. С. 163–173. EDN BELAJW.
24. Многолетняя изменчивость прозрачности воды в Черном море и факторы, обусло- вившие ее сильное снижение в конце 80-х – начале 90-х годов / В. И. Маньковский [и др.]. Севастополь : МГИ, 1996. 32 c.
25. The 1991 coccolithophore bloom in the central North Atlantic. 2. Relating optics to coc- colith concentration / W. M. Balch [et al.] // Limnology and Oceanography. 1996. Vol. 41, iss. 8. P. 1684–1696. https://doi.org/10.4319/lo.1996.41.8.1684
26. Чурилова Т. Я., Суслин В. В. О причинах доминирования Emiliania huxleyi в фито- планктоне глубоководной части Черного моря в начале лета // Экологическая без- опасность прибрежной и шельфовой зон и комплексное использование ресурсов шельфа. 2012. Вып. 26, т. 2. С. 195–203. EDN VWSEIL.
27. Optical properties of the particles in the Crimea coastal waters (Black Sea) / M. Chami [et al.] // Journal of Geophysical Research: Oceans. 2005. Vol. 110, iss. C11. C11020. https://doi.org/10.1029/2005JC003008
28. Лифанчук А. В., Федоров А. В. Смена экологических стратегий в фитопланктонном сообществе северо-восточной части Черного моря в течение годового цикла // Эко- логия гидросферы. 2018. № 1 (2). EDN YLRSLB.

















