Россия
Россия
Севастополь, Севастополь, Россия
Севастополь, Россия
Россия
Россия
Представлены результаты микробиологических исследований прибрежной акватории северо-западной части Тихого океана и Охотского моря, полученные в ходе экспедиции рейса 23/4 ПС «Профессор Мультановский» (август – сентябрь 2023 г.) в рамках программы «Плавучий университет». Определены количественные характеристики и изучено пространственное распределение бактерий, трансформирующих основные классы органических соединений, включая углеводороды нефти (дизельное топливо), липиды и фенолы в поверхностном и придонном слоях водной толщи. Численность гетеротрофных бактерий в этих слоях варьировала от 103 до 105 кл/мл. Численность углеводородокисляющих бактерий составляла от 1 до 102 кл/мл в поверхностном слое и от 1 до 10 кл/мл − в придонном. Численность липолитических бактерий изменялась от 10 до 103 кл/мл в обоих слоях, афенолокисляющей группы бактерий колебалась от 1 до 102 кл/мл. Исследованные группы бактерий распределены в прибрежной акватории п-ова Камчатка неравномерно. Максимальные показатели были зафиксированы в антропогенно нагруженной акватории Авачинской губы, эксплуатируемых бухтах и местах активного речного стока. В рассматриваемый период температура воды поверхностного слоя изменялась от 11.0 до 16.1 °С, придонного слоя – от 1.6 до 11.3 °С. Значения водородного показателя в воде поверхностного горизонта колебались в диапазоне от 8.38 до 8.49. Глубина на станциях отбора придонной воды варьировала от 13.5 до 780 м в Тихом океане и от 26 до 62 м в Охотском море. Значимых корреляционных связей между численностью определяемых групп микроорганизмов и указанными физико-химическими параметрами выявлено не было.
гетеротрофные бактерии, прибрежные воды, полуостров Кам- чатка, Авачинский залив, Охотское море
Введение
Прибрежные морские акватории представляют собой контактную зону, где смешиваются потоки загрязняющих веществ со стороны суши и моря. Кроме того, в таких акваториях часто ведется интенсивная хозяйственная дея- тельность. Различные органические вещества поступают в морские экосистемы, становясь значительным и постоянным экологическим фактором, и при этом подвергаются деструкции под действием микроорганизмов [1]. Углеводороды являются органическими загрязнителями, наиболее часто встречающимися в экосистемах [2, 3]. Весомый вклад в загрязнение морских вод, омывающих Камчатку, вносят нефтяные углеводороды и фенолы 1).
При загрязнении водоемов увеличение численности бактерий определен- ных групп зачастую наблюдается раньше, чем может быть зафиксировано из- менение химических показателей воды. Таким образом, микробиологические методы могут быть значительно чувствительнее санитарно-химических [4]. Так, в качестве индикаторов загрязнения вод углеводородами рассматрива- ются показатели численности углеводородокисляющих бактерий (УОБ), фено- лом – число фенолокисляющих бактерий (ФОБ), веществами липидного со- става – число липолитических бактерий (ЛЛБ) [5]. С учетом того, что в районе исследования расположена стоянка судов, заправляющихся дизельным топли- вом 2), и постоянно проводится его транспортировка и бункеровка судов [6, 7], в качестве единственного источника углерода и энергии для УОБ был выбран один из распространенных видов углеводородного сырья – дизельное топливо.
В исследованиях, направленных на мониторинг уровня загрязнения и оценку качества природных вод, особое внимание уделяется гетеротроф- ному компоненту микробных сообществ. Этот компонент выполняет ключе- вые функции в энергетическом балансе водных экосистем и играет важную роль в процессах самоочищения водоемов.
В прибрежных водах Восточной Камчатки и Охотского моря и ранее при- менялся метод микробной индикации для оперативной характеристики сте- пени загрязнения вод (определялась численность гетеротрофных микроорга- низмов, в том числе отдельных физиологических групп, таких как УОБ и ФОБ) в поверхностном слое воды в районе Авачинской бухты, в прибрежных аква- ториях о-ва Сахалин и в акватории порта Магадан в 2001 г. [8]. В 1997–1999 гг. также проводили микробиологические исследования в Авачинской бухте и вблизи северо-восточного побережья о-ва Сахалин (а также у северного При- морья и в зал. Петра Великого). Были изучены гетеротрофные микроорга- низмы из поверхностного и придонного водных слоев, но в контексте оценки экологического состояния акватории в условиях повышенного загрязнения среды тяжелыми металлами [9, 10]. В 2004–2006 гг. в прибрежных водах юга о. Сахалин исследовали численность гетеротрофных бактерий (ГБ), бактерий группы кишечной палочки, УОБ и ЛЛБ 3). В 2015 г. в Авачинской губе на ше- сти станциях в разные сезоны определяли численность сапрофитных микроор- ганизмов в морской воде и другие санитарно-микробиологические показатели [11]. В 2021 г. в качестве индикаторов загрязнения водотоков г. Петропавлов- ска-Камчатского были изучены УОБ [12]. Можно заключить, что исследова- ния численности гетеротрофных микроорганизмов разных эколого-трофиче- ских групп имели в основном эпизодический характер и в изучаемом нами рай- оне прибрежных вод п-ова Камчатка были локализованы в Авачинской бухте, тогда как прочие области исследованы недостаточно. В докладе о состоянии окружающей среды в Камчатском крае в 2022 г. можно найти информацию о загрязнении морских вод лишь для районов Авачинской губы и Халактыр- ского пляжа 1).
Цель работы – выявить особенности распределения бактерий разных ин- дикаторных групп в воде юго-восточных и юго-западных прибрежных аквато- рий п-ова Камчатка в летне-осенний период.
Материалы и методы
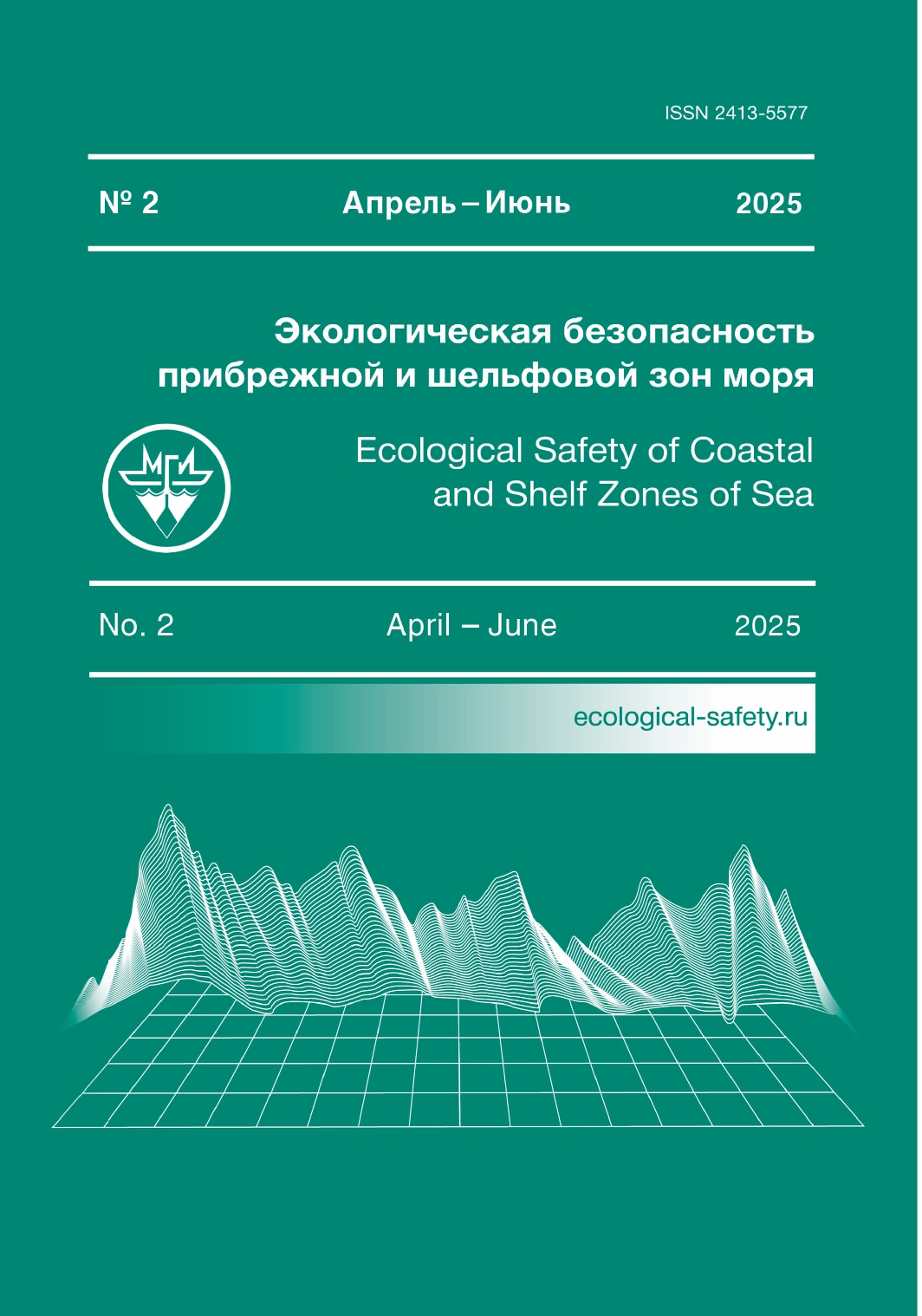
Работы проводили в летне-осенний период 2023 г. в рейсе ПС «Профессор Мультановский» в северо-западной части Тихого океана и Охотском море (рис. 1, табл. 1).
Станции отбора проб привязаны к зонам потенциально повышенного антропогенного воздействия: они расположены в бухтах, в морских устьевых областях крупных рек и в предустьевых пространствах, на водосборных тер- риториях которых имеются населенные пункты, сельскохозяйственные и про- мышленные объекты (рис. 1). Так, ст. 1–3 находятся внутри Авачинской губы, в том числе непосредственно у устья р. Авачи, ст. 4 – в проливе, соединяющем Авачинскую губу с океаном, ст. 15 – в нескольких километрах от выхода из бухты. Станции 6–8 расположены в районе Халактырского пляжа – у устья р. Налычева, где в 2020 г. были зафиксированы «красные приливы» [13, 14]; ст. 12 – у устья р. Вахиль и Островной; ст. 24 – в акватории б. Вилючинской,
Р и с . 1 . Карта точек отбора проб в прибрежной зоне п-ова Камчатка, 2023 г.
F i g. 1. Map of sampling points in the coastal zone of the Kamchatka Peninsula, 2023
куда впадают р. Вилюча и Жировая; ст. 30 была выполнена в б. Русской; ст. 35 – в б. Лиственничной, куда впадает одноименная река; ст. 56 – у устья р. Лысой и Кривой; ст. 70 – вблизи устья р. Озерной у пос. Озерновского.
Пробы воды из поверхностного горизонта отбирали батометром, придон- ную воду отбирали непосредственно из дночерпателя типа boxcorer.
В поверхностном и придонном слоях воды определяли численность ГБ, УОБ, ЛЛБ и ФОБ. Посев не осуществляли для проб из поверхностного слоя со ст. 28, из придонного слоя со ст. 7 (и со ст. 15 для ЛЛБ и ФОБ). Численность бактерий определяли методом предельных разведений с использованием жид- ких питательных сред. Для ГБ использовали среду с пептоном 4), для УОБ и ЛЛБ применяли среду Ворошиловой – Диановой [15], для ФОБ – модифи- цированную среду Калабиной [16]. В качестве единственного источника уг- лерода и энергии в каждую пробирку после посева для УОБ вносили 1 % стерильного дизельного топлива, для ЛЛБ – 1 % стерильного растительного масла. При приготовлении сред учитывали соленость морской воды. Наиболее вероятное число микроорганизмов в единице объема рассчитывали по таблице МакКреди, составленной на основе метода вариационной статистики. Пробы обрабатывали не позднее двух часов с момента отбора 5).
Т а б л ица 1 . Номера, координаты и глубины станций отбора проб в рейсе 23/4 ПС «Профессор Мультановский»
Tab l e 1 . Numbers, coordinates and depths of sampling stations on cruise 23/4 of PV Professor Multanovsky
|
Номер станции / Station number |
Широта, °с. ш. / Latitude, N |
Долгота, °в. д. / Longitude, E |
Глубина, м / Depth, m |
|
1 |
52° 59.53′ |
158° 32.42′ |
25.0 |
|
2 |
53° 00.79′ |
158° 35.61′ |
22.0 |
|
3 |
52° 59.30′ |
158° 31.62′ |
26.0 |
|
4 |
52° 49.63′ |
158° 42.48′ |
59.0 |
|
6 |
53° 08.08′ |
159° 14.30′ |
15.0 |
|
7 |
53° 08.16′ |
159° 14.76′ |
15.0 |
|
8 |
53° 08.34′ |
159° 15.43′ |
13.6 |
|
12 |
53° 09.64′ |
159° 26.02′ |
24.0 |
|
15 |
52° 44.53′ |
158° 46.80′ |
780.0 |
|
24 |
52° 37.52′ |
158° 26.95′ |
14.0 |
|
28 |
52° 33.41′ |
158° 41.42′ |
119.0 |
|
30 |
52° 24.65′ |
158° 26.16′ |
26.0 |
|
35 |
52° 20.94′ |
158° 31.61′ |
31.0 |
|
52 |
51° 02.34′ |
156° 33.73′ |
33.0 |
|
56 |
51° 07.49′ |
156° 28.44′ |
62.0 |
|
63 |
51° 36.75′ |
156° 25.30′ |
26.0 |
|
70 |
51° 30.38′ |
156° 20.24′ |
57.0 |
Для характеристики прибрежных вод как среды обитания микроорганиз- мов в поверхностном и придонном слоях фиксировали температуру, соленость с помощью CTD-зонда (CTD Sea-bird SBE 911plus) и значения водородного по- казателя в поверхностном водном слое с помощью рН-метра (FireSting-PRO). Карта точек отбора проб была построена в программе QGIS 3.34.11 с ис-
пользованием картографической подложки OpenStreetMap.
Результаты и обсуждение
За исследуемый период температура поверхностного слоя воды на изуча- емых станциях 1–35 в северо-западной части Тихого океана варьировала от 11.0 до 15.7 °C, придонного слоя – от 1.6 до 11.3 °C. Соленость воды изме- нялась в диапазоне от 26.8 до 30.8 ЕПС в поверхностном слое и от 31.2 до 34.1 ЕПС в придонном. Глубина отбора проб придонной воды составляла от 13.6 до 780 м (табл. 1, 2).
В Охотском море на станциях отбора проб 52–70 температура поверхност- ного слоя воды изменялась от 7.8 до 12.1 °C, придонного слоя – от 3.6 до 6.7 °C. Зафиксированная соленость воды в поверхностном слое изменялась в диапа- зоне 31.9–32.5 ЕПС, в придонном – в диапазоне 32.5–32.9 ЕПС. Глубина от- бора проб придонной воды варьировала от 26 до 62 м (табл. 1, 2).
Т а б л ица 2 . Температура и соленость в поверхностном и при- донном слоях воды на станциях отбора проб
Tab l e 2 . Temperature and salinity in the surface and bottom water layers at sampling stations
|
Номер станции / Station number |
Поверхностный слой / Surface layer |
Придонный слой / Bottom layer |
||
|
t, °C |
S, ЕПС / S, PSU |
t, °C |
S, ЕПС / S, PSU |
|
|
1 |
14.40 |
27.48 |
4.05 |
31,70 |
|
2 |
14.53 |
27.97 |
3.57 |
31.95 |
|
3 |
14.30 |
26.83 |
4.04 |
31.95 |
|
4 |
11.04 |
30.43 |
2.13 |
32.93 |
|
6 |
15.30 |
29.66 |
9.80 |
31.49 |
|
7 |
14.70 |
30.03 |
9.07 |
31.50 |
|
8 |
15.00 |
29.54 |
11.32 |
31.15 |
|
12 |
15.57 |
29.66 |
5.40 |
32.28 |
|
15 |
15.73 |
29.86 |
3.58 |
34.11 |
|
24 |
13.31 |
30.50 |
8.70 |
31.60 |
|
28 |
14.40 |
30.80 |
1.60 |
33.05 |
|
30 |
12.77 |
30.18 |
3.99 |
32.67 |
|
35 |
13.90 |
30.16 |
3.61 |
32.71 |
|
52 |
7.80 |
32.55 |
6.70 |
32.50 |
|
56 |
10.20 |
32.46 |
4.23 |
32.87 |
|
63 |
12.05 |
32.01 |
6.56 |
32.63 |
|
70 |
11.47 |
31.87 |
3.57 |
32.94 |
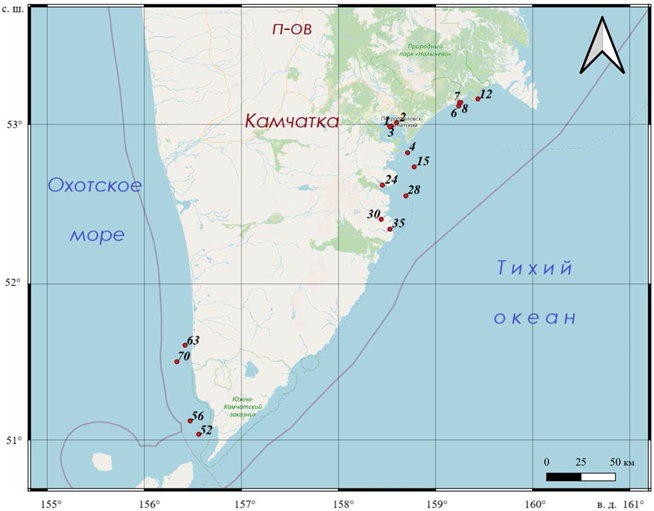
Бактерии-деструкторы органического вещества были обнаружены во всех пробах воды из обоих слоев (рис. 2). Численность ГБ и в поверхностном, и в придонном слое варьирует от 103 до 105 кл/мл. Статистически значимые различия между значениями численности бактерий в двух слоях отсутствуют. На основании определенной нами численности ГБ, согласно ГОСТ 17.1.2.04-77, 75 % проб воды северо-западной части Тихого океана относится к олиго- и бетамезасапробным водам. Исключения составляют пробы из поверхност- ного слоя со ст. 8, 24 и 30 и из придонного слоя со ст. 30 и 35: воды из этих проб относятся к полисапробным, т. е. по степени органического загрязнения – к «грязным» водам. В Охотском море отобранные из поверхностного слоя (на ст. 52 – из придонного) пробы воды по численности гетеротрофных мик- роорганизмов классифицируются как полисапробные (ГОСТ 17.1.2.04-77). Высокая численность ГБ свидетельствует о загрязнении вод органическими веществами, а также о высокой степени адаптации микроорганизмов к разру- шению этих веществ.
Р ис . 2 . Численность ГБ в поверхностном и придонном слоях водной толщи на исследуемых станциях
F i g. 2. Abundance (cells/mL) of heterotrophic bacteria in the sur- face and bottom layers of the water column at the studied stations
Станция 8 расположена у устья р. Налычева (самая большая площадь во- досбора среди рек Авачинской группы вулканов) и, вероятно, попадает в кон- тур повышенной мутности речного мутностного шлейфа [17]. Более высокое значение численности ГБ в поверхностном слое, по сравнению с придонным, на ст. 8 может свидетельствовать о поступлении органического вещества с реч- ным стоком.
Станции 24, 30 и 35 расположены в бухтах, имеющих высокую рекреаци- онную ценность: туристы часто посещают бухты на водном транспорте, что оказывает определенную антропогенную нагрузку. Кроме того, в этих бухтах находятся устья малых рек, которые могут служить источником поступления органических веществ в исследуемые акватории.
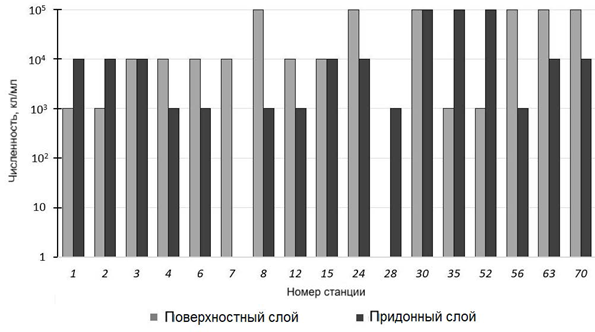
УОБ выделены в 100 % проб. Численность углеводородокисляющих бак- терий в морской воде на большинстве станций составляет 10 кл/мл в пробах из поверхностного слоя. Исключения составляют ст. 3 (в Авачинской губе) и ст. 35 (в б. Лиственничной) на Тихоокеанском побережье юго-восточной ча- сти Камчатки: на этих станциях в поверхностном слое их численность дости- гает 100 кл/мл, а на ст. 15 и 24 – 1 кл/мл. В воде Авачинской губы наибольшая концентрация растворенных углеводородов регулярно фиксируется в местах стоянки судов, сброса сточных вод судоремонтных заводов, транспортных пред- приятий. При этом приливо-отливные и сгонно-нагонные течения способствуют распространению нефтяных углеводородов на всю акваторию губы [18]. Отметим, что в мае 2022 г. был обнаружен сброс нефтепродуктов в районе пирса компании «Океанрыбфлот» (в губу попало 15 т нефтепродуктов). Во время разлива наблюдались высокие концентрации нефтяных углеводоро- дов в поверхностном слое бухты (на уровне 22–38 ПДК, до 1.7 мг/л), но уже спустя шесть месяцев после его ликвидации содержание углеводородов в воде в районе аварии снизилось в 2.5 раза [18].
Р и с . 3 . Численность УОБ в поверхностном и придонном слоях водной толщи на исследуемых станциях
F i g. 3. Abundance (cells/mL) of hydrocarbon-oxidizing bacteria in the surface and bottom layers of the water column at the studied stations
Численность УОБ в придонном горизонте на большинстве станций также составляет 10 кл/мл, однако на ст. 28, 30, 52, 56 и 70 определяются минималь- ные единичные значения (рис. 3).
Нет статистически значимой разницы между выборками в распределении численности бактерий на поверхности и в придонном слое морской воды.
Наибольший вклад в загрязнение прикамчатских вод вносят нефтяные уг- леводороды и фенолы. Отметим, что, по данным ФГБУ «Камчатское УГМС», среднее содержание нефтепродуктов в воде 22 рек полуострова с 2019 по 2022 г. снизилось более чем в восемь раз и в 2022 г. превышение ПДК было прибли- зительно двукратным. В морских прибрежных водах Камчатки – в Авачинской губе и в прибрежной части залива (район Халактырского пляжа) – среднее со- держание растворенных нефтяных углеводородов снизилось с примерно 2 ПДК в 2019 г. до 0.3 ПДК в 2022 г., однако в единичных случаях в Авачин- ской бухте встречались повышенные значения 1).
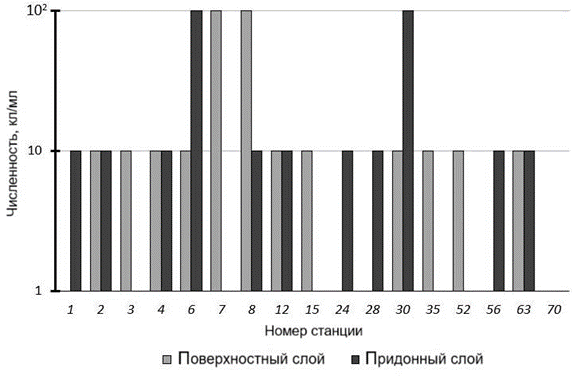
ФОБ выделены в 87.5 % проб из поверхностного слоя. На большинстве станций их численность составляет 10 кл/мл, на ст. 7 и 8 (в районе Халактыр- ского пляжа, на разном удалении от устья р. Налычева) и на ст. 30 в б. Русской (рис. 4) – 100 кл/мл, на ст. 1 и 24 – 1 кл/мл.
ФОБ выделены в 93.3 % проб из придонного слоя. На большинстве стан- ций их численность равна 10 кл/мл, на ст. 6 (в районе Халактырского пляжа) и на ст. 30 в б. Русской (рис. 4) – 100 кл/мл, на ст. 3, 52 и 70 – 1 кл/мл.
Статистически значимые различия между численностью ФОБ в поверх- ностном и в придонном слоях отсутствуют.
За пятилетний (2018–2022 гг.) период наблюдений ФГБУ «Камчатское УГМС» среднегодовое количество фенолов в прибрежных морских водах
Р и с . 4 . Численность ФОБ в поверхностном и придонном слоях водной толщи на исследуемых станциях
F i g. 4. Abundance (cells/mL) of phenol-oxidizing bacteria in the surface and bottom layers of the water column at the studi- ed stations
уменьшилось с 2 до 0.3 ПДК. При этом фенол отмечен в числе основных пол- лютантов, загрязняющих объекты речной сети полуострова. Его среднее со- держание в речной воде с 2019 по 2022 г. оставалось на уровне 5–6 ПДК 1).
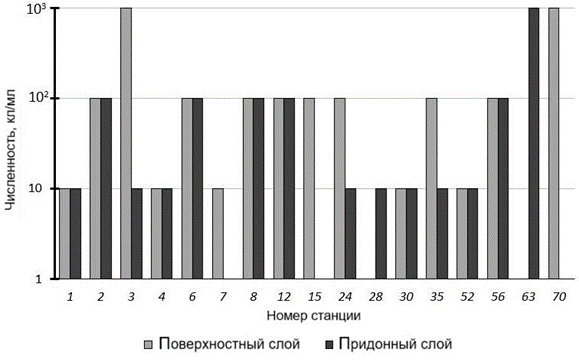
ЛЛБ выделены в 100 % проб. Численность бактерий, способных окислять липиды, изменялась в широком диапазоне от 1 до 1000 кл/мл в пробах воды как из поверхностного слоя, так и из придонного (рис. 5).
В поверхностном слое максимальное значение численности (1000 кл/мл) отмечено на ст. 3 и 70, минимальное значение (1 кл/мл) – на ст. 63. В придон- ном слое максимальное значение (1000 кл/мл) зафиксировано на ст. 63, мини- мальное значение 1 кл/мл – на ст. 70.
Статистически значимые различия между численностью ЛЛБ в поверх- ностном и в придонном слоях отсутствуют. Коэффициент корреляции между численностью УОБ и ЛЛБ составляет 0.4 (P = 0.05), что соответствует слабой положительной корреляционной связи. Отметим, что липиды могут образовы- ваться в ходе биодеградации нефти.
Существует ряд факторов, определяющих численность микроорганизмов в морской воде: температура, соленость, глубина и др. Данные о температуре воды, полученные в ходе исследования, соответствуют оптимальным усло- виям развития психрофильных и психротрофных микроорганизмов. Зафикси- рованные в изучаемом районе значения водородного показателя воды благо- приятны для существования УОБ [19].
Значимых корреляционных связей между численностью изучаемых групп микроорганизмов и значениями таких показателей, как температура поверх- ностной и придонной воды, соленость и глубина, выявлено не было.
Полученная численность ГБ сопоставима с данными для прибрежных ак- ваторий о. Сахалин в 2004–2006 гг.: летний диапазон колебаний
Р ис . 5 . Численность ЛЛБ в поверхностном и придонном слоях водной толщи на исследуемых станциях
F i g. 5. Abundance (cells/mL) of lipolytic bacteria in the sur- face and bottom layers of the water column at the studied stations
средней численности гетеротрофных микроорганизмов составил от 6·103 кл/мл (пос. Пригородное) до 45·107 кл/мл (порт Корсаков). В летний период воды портов Холмск и Корсаков, а также б. Лососей соответствовали категории
«очень грязные», воды остальных станций – «грязные». Прибрежные акватории о. Сахалин являются районом с множеством источников нефтяного загрязне- ния как антропогенного, так и природного происхождения: в летний период доля УОБ от общего числа гетеротрофов здесь составляла от 60 % (пос. Охотск) до 80 % (пос. Золоторыбное) 3), что в несколько раз больше полученных нами количественных характеристик УОБ (см. рис. 3). Отметим также значения аб- солютной численности планктонных гетеротрофных колониеобразующих микроорганизмов, изученных ранее в пробах воды акватории Авачинской губы в июле 1999 г.: их численность составляла от 1.63·104 ± 0 кл/мл в б. Тур- панка до 7.98·105 ± 0.83·105 кл/мл в б. Раковой [9].
Выводы
В ходе исследования были выявлены особенности пространственного распределения бактерий, способных к окислению разных групп органических веществ, и их количественные характеристики в поверхностном и придонном слоях вод юго-восточных и юго-западных прибрежных акваторий п-ова Кам- чатка в августе – сентябре 2023 г. Численность всех исследуемых групп бакте- рий колебалась в широких пределах и распределена в прибрежной акватории полуострова неравномерно. Максимальные показатели зафиксированы в ан- тропогенно нагруженной акватории Авачинской губы, эксплуатируемых бух- тах и местах активного речного стока. Локальная высокая численность ГБ сви- детельствует как о загрязнении вод органическими веществами, так и о высо- ком потенциале вод к самоочищению.
Изученные физиологические группы бактерий не имеют достоверных раз- личий в численности в поверхностном и придонном слоях. Значимых корреля- ционных зависимостей между численностью бактерий разных групп и такими параметрами, как соленость, температура и глубина, не обнаружено.си.
1. Pandolfo E., Caracciolo A. B., Rolando L. Recent advances in bacterial degradation of hydrocarbons // Water. 2023. Vol. 15, iss. 2. 375. https://doi.org/10.3390/w15020375
2. Giri K., Rai J. P. N. Bacterial metabolism of petroleum hydrocarbons // Biotechnology. Vol. 11 : Biodegradation and Bioremediation. Studium Press India Pvt. Ltd., 2014. P. 73–93.
3. Plant-assisted remediation of hydrocarbons in water and soil: Application, mechanisms, challenges and opportunities. / S. R. S. Abdullah [et al.] // Chemosphere. 2020. Vol. 247. 125932. https://doi.org/10.1016/j.chemosphere.2020.125932
4. Немировская И. А. Нефть в океане (загрязнение и природные потоки). Москва : Научный мир, 2013. 428 с. EDN YMMLMD.
5. Миронов О. Г. Бактериальная трансформация нефтяных углеводородов в прибрежной зоне моря // Морской экологический журнал. 2002. Т. 1, № 1. С. 56–66. EDN SBJIRZ.
6. Труднев С. Ю., Нистор А. С. Анализ аварийности судов рыбопромыслового флота Дальнего Востока // Техническая эксплуатация водного транспорта: проблемы и пути развития. Материалы Второй международной научно-технической конфе- ренции (23–25 октября 2019 г.). Петропавловск-Камчатский : КамчатГТУ, 2020. С. 66–69. EDN XYTWWY.
7. Шевцов М. Н., Макарова В. С. Оценка возможных негативных последствий от аварийного разлива нефтепродуктов на морской акватории в ходе операций по пере- грузке грузов с барж // Вестник Тихоокеанского государственного университета. 2023. № 1. С. 153–160. EDN GXGKYS.
8. Журавель Е. В., Безвербная И. П., Бузолева Л. С. Микробная индикация загрязнения прибрежных вод Охотского моря и Авачинской бухты // Биология моря. 2004. Т. 30, № 2. С. 138–142. EDN EBRWPD.
9. Димитриева Г. Ю., Безвербная И. П., Христофорова Н. К. Микробная индикация – возможный подход для мониторинга тяжелых металлов в дальневосточных морях // Известия ТИНРО. 2001. Т. 128, № 3. С. 719–736. EDN IBXEFX.
10. Димитриева Г. Ю., Безвербная И. П. Микробная индикация – эффективный инструмент для мониторинга загрязнения прибрежных морских вод тяжелыми металлами // Океанология. 2002. Т. 42, № 3. С. 408–415.
11. Сергеенко Н. В., Устименко Е. А. Санитарно-микробиологические показатели воды Авачинской губы // Морские биологические исследования: достижения и перспективы : сборник материалов Всероссийской научно-практической конференции с международным участием, приуроченной к 145-летию Севастопольской биологической станции : в 3 томах, Севастополь, 19–24 сентября 2016 года. Севостополь : ЭКОСИ-Гидрофизика, 2016. Т. 3. С. 214–217. EDN XEVIHB.
12. Конева М. Н., Ступникова Н. А. Нефтеокисляющие микроорганизмы как индикаторы нефтяного загрязнения водотоков г. Петропавловска-Камчатского // Между- народный научно-исследовательский журнал. 2021. № 7. С. 23–27. EDN LIFJND. https://doi.org/10.23670/IRJ.2021.109.7.037
13. Санамян Н. П., Коробок А. В., Санамян К. Э. Качественная оценка последствий влияния вредоносного цветения водорослей осенью 2020 года у побережья юго- восточной Камчатки (северо-западная пацифика) на мелководные бентосные сообщества // Вестник Камчатского государственного технического университета. 2023. № 63. С. 22–44. EDN GKLENO. https://doi.org/10.17217/2079-0333-2023-63-22-44
14. The mysterious mass death of marine organisms on the Kamchatka Peninsula: A consequence of a technogenic impact on the environment or a natural phenomenon? / Z. В. Khesina [et al.] // Marine Pollution Bulletin. 2021. Vol. 166. 112175. EDN GSGHCL. https://doi.org/10.1016/j.marpolbul.2021.112175
15. Ворошилова А. А., Дианова Е. В. Окисляющие нефть бактерии – показатели интенсивности биологического окисления нефти в природных условиях // Микробиология. 1952. Т. 21, № 4. С. 408–415.
16. Ермолаев К. К., Миронов О. Г. Роль фенолразрушающих микроорганизмов в процессе деструкции фенола в Черном море // Микробиология. 1975. Т. 10, № 5. С. 928–932. EDN KWMELJ.
17. К оценке возможного влияния материкового стока на гибель гидробионтов в Авачинском заливе Тихого океана (Камчатка) / С. Р. Чалов [и др.] // Известия Русского географического общества. 2022. Т. 154, № 4. С. 69–84. EDN YNPFBT. https://doi.org/10.31857/S0869607122040048
18. Русанова В. А., Седова Н. А. Определение содержания нефтепродуктов в воде и донных отложениях Авачинской губы в 2022 году // Природные ресурсы, их со- временное состояние, охрана, промысловое и техническое использование : мате- риалы XIV Национальной (всероссийской) научно-практической конференции (21–22 марта 2023 г.). Петропавловск-Камчатский : КамчатГТУ, 2023. С. 149–152. EDN PXLPPJ. https://doi.org/10.24412/cl-35030-2023-1-149-152
19. Biological degradation and bioremediation of toxic chemicals / edited by G. R. Chaudhry. Oregon : Dioscorides Press, 1994. 515 p.