Севастополь, Россия
Севастополь, Россия
УДК 581.526.323 Бентос. Фитобентос
Представлены результаты исследования современного состояния макрофитобентоса в восточной части б. Севастопольской. В ходе изучения собраны сведения о распре-делении ключевых видов макрофитов и проведен сравнительный анализ изменений их вклада в общую биомассу макрофитобентоса за период более 40 лет. Гидробота-нические исследования выполняли согласно стандартной методики по одним и тем же разрезам в летний период 1977, 2017 и 2024 гг. Выявлено, что в настоящее время (2017 и 2024 гг.) в составе донной растительности доминируют Gongolaria barbata и Ericaria crinita, также обильно представлены зеленые водоросли (Cladophora laetevirens, Ulva intestinalis, U. rigida). В 2024 г. почти на всех разрезах на глубине 0.5 м отмечено снижение общей биомассы макрофитов, доли G. barbata и E. crinita вследствие разрушительного воздействия экстремального шторма. При этом на глу-бине 1 и 3 м количественные показатели биомассы макрофитобентоса были пример-но вдвое выше, чем в 2017 г. Сравнительный анализ распределения макрофитобен-тоса за почти полувековой период показал, что наиболее существенная трансформация растительной компоненты произошла в кутовой части бухты, где произрас-тающая здесь ранее высшая водная растительность (Zostera marina, Z. noltei, Stuckenia pectinata, Zannichellia sp., Ruppia sp.) сменилась зарослями многолетних водорослей (G. barbata и E. crinita). Эти изменения, вероятно, можно объяснить по-вышением солености воды в приустьевой зоне р. Черной, а также изменением интен-сивности вдольбереговых потоков наносов в акватории. В восточной части бухты за этот период зарегистрирована смена доминантных видов водорослей: вместо пред-ставителей рода Ulva начали преобладать виды G. barbata и E. crinita, что, возмож-но, свидетельствует об улучшении качества среды. Результаты работы могут быть применены при мониторинге состояния морской среды в бухте, а также при плани-ровании охранных мероприятий прибрежной зоны моря.
макрофитобентос, Gongolaria barbata, Ericaria crinita, Ulva rigida, Cladophora laetevirens, Черное море, Севастополь
Введение
В стабилизации прибрежных геосистем ведущую роль играет макрофито- бентос, обеспечивая ряд экосистемных функций и услуг [1–3]. Общеизвестно, что подводный растительный покров активно реагирует на изменения окру- жающей среды. В связи с этим изменения видового состава и количествен- ных характеристик макрофитов позволяют использовать фитобентос в каче- стве своеобразного индикатора экологического состояния прибрежных вод.
Глубина распространения донной растительности определяется границей фотического слоя, где происходит фотосинтез водорослей, который во мно- гом зависит от прозрачности воды. В связи с этим исследование макрофито- бентоса приобретает актуальность для акваторий, которые подвержены ин- тенсивному влиянию хозяйственной деятельности.
В качестве модельного региона выбрана восточная часть б. Севастополь- ской, подверженная длительному антропогенному воздействию, в частности в бухту поступают существенные объемы сточных вод [4–6]. Изучаемая аква- тория является зоной активного судоходства, проведения дноуглубительных и иных гидротехнических работ, что обусловливает повышенные значения загрязняющих веществ в воде [7, 8]. Характерно, что этой части бухты по- священо значительное количество современных исследований, касающихся гидролого-гидрохимических показателей среды [9, 10], литологической струк- туры донных отложений [11–14], количественных характеристик сообществ мейо- и макрозообентоса [15–18], однако работы по изучению донной расти- тельности остаются малочисленными [19–22].
Целью статьи является оценка современного состояния макрофитобентоса в восточной части б. Севастопольской и выявление особенностей межгодовой динамики распределения доминирующих видов макрофитов за 1977–2024 гг.
Материалы и методы исследования
Восточная часть б. Севастопольской имеет среднюю глубину 13.1 м с максимальными значениями по фарватеру до 19.5 м. Морская акватория отличается сложным гидродинамическим режимом, который определяется двумя встречными потоками: один направлен с востока на запад со стороны р. Черной, а второй – с запада на восток со стороны открытой части моря. На экологическое состояние вод этой части бухты также оказывает влияние водообмен с б. Южной [4, 6, 23].
Кутовая часть бухты мелководна, ее средняя глубина составляет 4.7 м, максимальная – 10.8 м [7]. На эту полузамкнутую часть акватории оказывает влияние р. Черная, что проявляется в опреснении поверхностных вод бухты и поступлении с речным стоком значительного объема аллохтонных органи- ческих и минеральных веществ, в том числе биогенных элементов и загряз- няющих веществ [23].
В современных условиях территория, прилегающая к восточному берегу бухты, претерпела существенные изменения. В последние десятилетия были проведены работы по укреплению берега, построены волнорезы и причалы. Так, в преобразованном устье р. Черной расположен ковш Севастопольского морского порта, при этом пойменная часть реки занята молом и судоходным каналом «Река Черная» [24].
Материалом для исследования послужили пробы фитобентоса, собран- ные в б. Севастопольской в июле 2017 и 2024 гг. Пробы отбирали по методу вертикальных разрезов с помощью водолаза на глубинах 0.5; 1; 3 и 5 м до гра- ницы распространения макрофитов в четырехкратной повторности с приме- нением учетных площадок размером 25 × 25 см 1). В результате собрано и об- работано 96 количественных проб (табл. 1). Целью работы было изучение распределения и биомассы макрофитобентоса в прибрежной зоне восточной части бухты (разрезы 1–5) (рис. 1). Для определения координат разрезов ис- пользовали портативный GPS-приемник Oregon 650. Результаты измерений представлены в табл. 1.
Донную растительность описывали с использованием доминантной клас- сификации, предложенной А. А. Калугиной-Гутник 2). Для анализа структуры фитосообществ был рассчитан индекс видового разнообразия Шеннона (H). При идентификации видов водорослей руководствовались определителем 3) с учетом последних номенклатурных ревизий 4). Данные о составе и распро- странении донной растительности в бухте за 1977 г. были получены одним из авторов, который участвовал в сборе материала в летний период в иссле- дуемых районах и его обработке с использованием аналогичной методики.


Р и с . 1 . Картосхема гидроботанических разрезов в восточной части б. Севастопольской: 1 – м. Павловский; 2 – балка Ушакова; 3 – ТЭЦ; 4 – Инкерман; 5 – Голландия
F i g . 1 . Schematic map of hydrobotanical profiles in the western part of Sevastopol Bay: 1 – Сape Pavlovsky; 2 – Ushakov Beam; 3 – thermal sta- tion; 4 – Inkerman; 5 – Gollandia
1) Калугина А. А. Исследование донной растительности Черного моря с применением легково- долазной техники // Морские подводные исследования. Москва : Наука, 1969. С. 105–113.
2) Калугина-Гутник А. А. Фитобентос Черного моря. Киев : Наукова думка, 1975. 248 с.
3) Зинова А. Д. Определитель зеленых, бурых и красных водорослей южных морей СССР. Ленинград : Наука, 1967. 397 с.
4) URL: http://www.algaebase.org (date of access: 22 August 2025).
Т а б л и ц а 1 . Координаты разрезов, диапазон глубин, количество отобранных проб макрофитобентоса в б. Севастопольской
T a b l e 1 . Coordinates and depth range of hydrobotanical profiles, number of sampled macrophytobenthos in Sevastopol Bay
|
Разрез / Profile |
Координаты / Coordinates |
Глубина, м / Depth, m |
Количество проб / Number of samples |
||||
|
° с. ш. |
° в. д. |
0.5 |
1 |
3 |
5 |
||
|
1 |
44°36¢57² |
33°32¢4² |
+/0 |
+/0 |
+/0 |
+/0 |
16 |
|
2 |
44°36¢57² |
33°32¢42² |
+/+ |
+/+ |
+/+ |
+/− |
28 |
|
3 |
44°36¢37² |
33°34¢57² |
+/+ |
+/+ |
– |
– |
16 |
|
4 |
44°36¢30² |
33°36¢05² |
+/+ |
+/+ |
– |
– |
16 |
|
5 |
44°37¢23² |
33°33¢39² |
+/+ |
+/+ |
−/+ |
– |
20 |
П р и м е ч а н и е . В числителе указаны пробы, отобранные в 2017 г., в знаменателе – в 2024 г. Символ «+» означает наличие донной растительности, «–» – отсутствие, «0» – пробы не отбирали.
Note: Numerator – samples taken in 2017; denominator – samples taken in 2024. Symbol “+” denotes presence of bottom vegetation, and symbol “–” denotes its absence, “0” – no samples were taken.
Результаты и обсуждение
Анализ полученных данных показал, что донная растительность в восточ- ной части б. Севастопольской сосредоточена в основном на глубине от 0.5 до 3 м, а в кутовой части – на глубине от 0.5 до 1 м. В начале 2000-х гг. О. Г. Миронов и его коллеги отмечали в этой части бухты на глубине более 5 м темно-серые и черные илы, которые часто пахнут сероводородом и мазу- том [11]. Известно, что загрязнение акваторий органическими веществами, нефтью и ее производными, которые попадают в воду с речными, промышлен- ными, сельскохозяйственными и бытовыми стоками, приводит к ухудшению кислородного режима, значительному заиливанию грунта и, как следствие, к деградации ландшафтного и биологического разнообразия [6, 13–15, 25].
Распределение донной растительности в восточной части бухты в 2017 и 2024 гг.
Разрез 1. В 2017 г. на этом разрезе общая биомасса макрофитов (ОБМ) с увеличением глубины от 0.5 до 1 м снижалась в 1.5 раза, при этом доля гос- подствующего вида сокращалась примерно вдвое (табл. 2). На этих глубинах доминировала Gongolaria barbata (Stackhouse) Kuntze (= Cystoseira barbata) (рис. 2). В составе макрофитобентоса на исследованных глубинах встреча- лись Dictyota fasciola (Roth) Howe (9–18 %) и Cladophora laetevirens (Dillw.) Kütz. (10–21 % ОБМ) (рис. 2). Доля эпифитов на глубинах 0.5–1 м была не- значительная (табл. 2). Характерно, что на глубине 5 м донная растительность почти отсутствовала, основной вклад в ОБМ вносили C. laetevirens (60 %) и Ulva rigida L. (17 %). В составе сообщества на этой глубине единично реги- стрировали особи Zostera marina L. Индекс видового разнообразия с увели- чением глубины возрастал от 1.07 до 2.07, что свидетельствует об усложне- нии структуры сообщества.
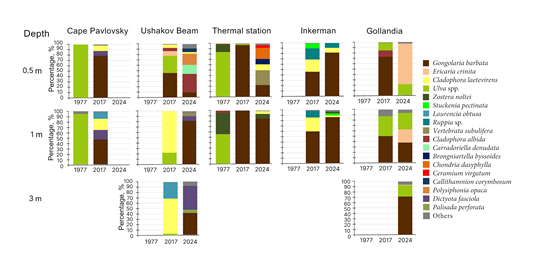
Р и с . 2 . Межгодовая и пространственная динамика ви- дового состава доминирующих макрофитов
F i g . 2 . Interannual and spatial dynamics of species compo- sition of dominant macrophytes
Разрез 2. В 2017 г. на этом разрезе на глубине 0.5 м свыше половины ОБМ приходилось на G. barbata и Ericaria crinita (Duby) Molinari & Guiry (= Cystoseira crinita) (табл. 2). На этой глубине в составе макрофитобентоса были обильно представлены зеленые водоросли: U. rigida (32 %), C. laetevirens (6 %), C. albida (Nees) Kütz. (6 % ОБМ) (рис. 2). На глубине 1–3 м господ- ствовала C. laetevirens (рис. 2). ОБМ с увеличением глубины в этом диапа- зоне снижалась в 1.4 раза, при этом вклад преобладающего вида достигал 66– 78 % (табл. 2). В составе сообщества на этих глубинах также отмечена
U. rigida (3–22 % ОБМ) (рис. 2). Характерно, что на глубине 3 м обильно встречалась литофитная форма Laurencia obtusa (Huds.) J. V. Lamour. (30 % ОБМ) (рис. 2). На глубине 5 м ОБМ была низкой, среди водорослей домини- ровала C. albida, на ее долю приходилось 94 % (табл. 2). На этом горизонте в составе макрофитобентоса была зафиксирована C. laetevirens (3 % ОБМ) (рис. 2). Вклад эпифитных водорослей в ОБМ на разрезе 2 был невысокий и варьировал от 0 до 5 % (табл. 2). Индекс видового разнообразия с увеличе- нием глубины снижался примерно в пять раз (с 2.00 до 0.43) (табл. 2).
В 2024 г. на разрезе 2 донная растительность была зарегистрирована до горизонта 3 м. На глубине 0.5 м ОБМ была почти на порядок ниже, чем в 2017 г. (табл. 2). На этой глубине вместо зарослей G. barbata и E. crinita об- наружены лишь их проростки, доля которых составляла всего 9 % ОБМ (рис. 2). Здесь обильно встречались C. albida (35 %), Polysiphonia opaca (C. Ag.) Moris et De Notaris (21 %), Carradoriella denudata (Dillwyn) Savoie et G. W. Saunders (17 %), Callithamnion corymbosum (Smith) Lyngb. (7 % ОБМ) (рис. 2). Эпифи- тирующие виды водорослей не зафиксированы. На глубине 1–3 м ОБМ была в два – три раза выше, чем в 2017 г. (табл. 2). На этих глубинах преобладала
G. barbata, хотя ее вклад с увеличением глубины от 1 до 3 м снижался вдвое, тогда как доля D. fasciola возрастала с 9 до 45 % ОБМ (рис. 2). Вклад эпифи- тов колебался в пределах 6–7 % ОБМ. Показательно, что за изучаемый период
Т а б л и ц а 2 . Распределение доминирующих и эпифитирующих видов макрофитов и индекса видового разнообразия Н в Севастопольской бухте в 1977, 2017 и 2024 гг. (по глубинам)
T a b l e 2 . Distribution of dominant macrophyte and epiphyte species and diversity index
H in Sevastopol Bay in 1977, 2017 and 2024 (by depths)
|
Разрез / Profile |
Глубина, м / Depth, m |
Год / Year |
ОБМ, г·м−2 / Total biomass of macrophytes, g·m−2 |
Доля, % / Proportion, % |
Н |
|
|
Gongolaria barbata, Ericaria crinita |
эпифитов / Epiphytic |
|||||
|
1 |
0.5 |
1977 |
858.3 ± 45.7 |
0 |
0 |
0.67 |
|
2017 |
1783.8 ± 837.9 |
79 |
1 |
1.07 |
||
|
1 |
1977 |
1171.7 ± 207.8 |
0 |
0 |
1.18 |
|
|
2017 |
1192.5 ± 189.9 |
47 |
2 |
1.96 |
||
|
3 |
1977 |
145.2 ± 37.9 |
0 |
0 |
0 |
|
|
5 |
2017 |
16.1 ± 2.5 |
0 |
5 |
2.07 |
|
|
2 |
0.5 |
2017 |
3333.2 ± 603.6 |
55 |
5 |
2.00 |
|
2024 |
357.2 ± 93.5 |
9 |
0 |
2.91 |
||
|
1 |
2017 |
1332.3 ± 192.3 |
0 |
0 |
0.77 |
|
|
2024 |
3782.4 ± 786.9 |
82 |
7 |
1.05 |
||
|
3 |
2017 |
980.0 ± 326.9 |
0 |
2 |
1.13 |
|
|
2024 |
1834.6 ± 247.2 |
41 |
6 |
1.77 |
||
|
5 |
2017 |
49.5 ± 5.16 |
0 |
0 |
0.43 |
|
|
3 |
|
1977 |
231.6 ± 55.8 |
0 |
0 |
1.42 |
|
0.5 |
2017 |
4042.8 ± 1738.5 |
97 |
0 |
0.24 |
|
|
|
2024 |
1394.8 ± 198.5 |
22 |
0 |
2.60 |
|
|
|
1977 |
353.8 ± 96.2 |
0 |
0 |
1.74 |
|
|
1 |
2017 |
1957.4 ± 665.0 |
100 |
0 |
0.05 |
|
|
|
2024 |
3308.8 ± 976.9 |
85 |
5 |
0.80 |
|
|
4 |
0.5 |
2017 |
1738.0 ± 540.5 |
46 |
1 |
4.27 |
|
2024 |
4340.7 ± 1067.3 |
82 |
0 |
0.89 |
||
|
|
2017 |
1467.4 ± 493.8 |
60 |
5 |
1.03 |
|
|
1 |
2024 |
2811.4 ± 273.5 |
87 |
0 |
0.88 |
|
|
5 |
0.5 |
2017 |
4532.2 ± 456.7 |
73 |
14 |
1.23 |
|
2024 |
3888.4 ± 1158.5 |
76 |
1 |
1.09 |
||
|
1 |
2017 |
3146.3 ± 336.9 |
92 |
5 |
0.69 |
|
|
2024 |
7307.7 ± 1754.1 |
94 |
0 |
0.68 |
||
|
3 |
2024 |
1647.8 ± 583.2 |
73 |
4 |
1.48 |
|
П р и м е ч а н и е . Сведения за 1977 г. получены из статьи А. А. Калугиной-Гутник [26]. N o t e : Data for 1977 are taken from the article by A. A. Kalugina-Gutnik [26].
на всех исследованных глубинах отмечено увеличение индекса видового раз- нообразия, что свидетельствует об усложнении структуры альгосообщества (табл. 2).
Разрез 3. В 2017 г. на этом разрезе ОБМ с увеличением глубины от 0.5 до 1 м снижалась в два раза (табл. 2). На этих глубинах господствовала G. barbata, доля вида достигала максимальных значений (рис. 2). В составе сообщества еди- нично отмечены U. rigida и C. laetevirens. Эпифитные водоросли не обнаружены. Низкие значения индекса видового разнообразия Н свидетельствуют об одно- родной структуре фитосообщества с преобладанием вида-доминанта (табл. 2).
В 2024 г. на разрезе 3 на глубине 0.5 м ОБМ снизилась в три раза, а на глу- бине 1 м возросла вдвое по сравнению с аналогичными показателями в 2017 г. (табл. 2). На этих горизонтах также преобладала G. barbata, хотя ее вклад уменьшился, особенно на глубине 0.5 м, где была высока доля литофитных форм Vertebrata subulifera (C. Ag.) Kütz. (28 %), Brongniartella byssoides (Good. et Wood.) F. Schmitz (10 %), Chondria dasyphylla (Woodw.) C. Ag. (21 %),
C. laetevirens (11 %) и Ceramium virgatum Roth (5 % ОБМ) (рис. 2). Характер- но, что на глубине 1 м, при доминировании G. barbata, на прогалинах с или- сто-песчаным дном встречалась Zostera noltei Hornem. (9 % ОБМ). Эпифит- ные водоросли были представлены C. laetevirens. Упрощение структуры аль- госообщества с увеличением глубины подтверждается более чем трехкрат- ным уменьшением значения индекса видового разнообразия (табл. 2).
Разрез 4. В 2017 г. на этом разрезе ОБМ незначительно снижалась с уве- личением глубины от 0.5 до 1 м, при этом возрастала доля преобладающего вида (G. barbata) (табл. 2). На этой глубине в составе макрофитобентоса, по- мимо зеленых водорослей (C. laetevirens (23–26 %) и U. rigida (1–2 %)), была отмечена высшая водная растительность, представленная родами Ruppia, Stuckenia, Zannichellia (12–30 % ОБМ) (рис. 2). Вклад эпифитов с увеличени- ем глубины возрастал от 1 до 5 % ОБМ. Показательно, что на глубине 0.5 м было зарегистрировано максимальное значение индекса видового разнообра- зия, что свидетельствует о полидоминантной структуре сообщества (табл. 2).
В 2024 г. на разрезе 4 распределение фитобентоса по глубинам остава- лось неизменным по сравнению с предыдущими годами. ОБМ с увеличением глубины от 0.5 до 1 м снижалась в 1.5 раза, при этом ее значения были примерно вдвое выше, чем в 2017 г. (табл. 2). На этих горизонтах доминирующим ви- дом являлась G. barbata. В составе макрофитобентоса отмечены C. laetevirens (3–9 %) и морские травы Ruppia spiralis L., Stuckenia pectinata (L.) Börner (= Potamogeton pectinatus), Z. noltei (7–9 % ОБМ) (рис. 2). Эпифитные водо- росли не обнаружены. Индекс видового разнообразия варьирует в узком ин- тервале (табл. 2).
Разрез 5. В 2017 г. на этом разрезе ОБМ с увеличением глубины от 0.5 до 1 м снижалась в 1.4 раза (табл. 2). На этих глубинах господствовала
G. barbata, ее доля была высокой и изменялась от 73 до 92 % ОБМ. На этих горизонтах также отмечены U. rigida и C. albida, при этом их вклад с глу- биной снижался от 14 до 6 % и от 12 до 1 % ОБМ соответственно (рис. 2). Характерно, что с увеличением глубины доля эпифитов уменьшалась почти в три раза, упрощалась структура сообщества, индекс видового разнообразия уменьшался вдвое (табл. 2).
В 2024 г. на разрезе 5 донная растительность была зарегистрирована до горизонта 3 м. Наибольшая ОБМ была отмечена на глубине 1 м, на глу- бине 0.5 м этот показатель был ниже почти вдвое, а на глубине 3 м – вчетверо (табл. 2). На всех исследованных горизонтах доминировали E. crinita и
G. barbata, их вклад варьировал от 73 до 94 % ОБМ. Остальная часть ОБМ приходилась в основном на виды рода Ulva (рис. 2). Показательно, что за изу- чаемый период на глубине 0.5 м значения ОБМ и доли господствующих видов оказались соизмеримыми, тогда как на глубине 1 м показатель ОБМ в 2024 г. был вдвое выше, чем в 2017 г., хотя вклад преобладающих видов был при- мерно одинаковый (табл. 2). Эпифитные водоросли были представлены слабо (0–4 % ОБМ). Индекс видового разнообразия изменялся от 0.68 до 1.48, что характерно для альгосообщества с преобладанием доминирующих видов.
Таким образом, за прошедшие семь лет (с 2017 по 2024 г.) в восточной части б. Севастопольской в распределении макрофитобентоса по глубинам произошли перестройки, хотя в целом видовой состав массовых макрофитов изменился незначительно. Показательно, что в 2024 г. на всех разрезах, за ис- ключением разреза 4, ОБМ на глубине 0.5 м была ниже, а на глубине 1 и 3 м примерно вдвое выше, чем в 2017 г. Причину существенного снижения ОБМ на глубине 0.5 м, вероятно, можно объяснить последствием разрушительного воздействия экстремального шторма, произошедшего осенью 2023 г. [27]. Так, в 2024 г. на разрезе 2 ОБМ почти в десять раз ниже, чем в 2017 г. (табл. 2). На этой глубине были отмечены лишь проростки G. barbata и E. crinita, их доля за изучаемый период уменьшилась с 55 до 9 % ОБМ (рис. 2). На разре- зе 3 на глубине 0.5 м ОБМ снизилась в три раза, по сравнению с аналогичным значением, зафиксированным в 2017 г. (табл. 2). Здесь были зарегистрирова- ны единичные слоевища G. barbata, вклад которой за этот период уменьшил- ся с 97 до 22 % ОБМ (рис. 2). На разрезе 5 за прошедшие семь лет на глубине
0.5 м снижение ОБМ было незначительным, при этом доля G. barbata варьи- ровала в интервале (73–76 % ОБМ) (табл. 2). Характерно, что в 2024 г. на всех исследованных разрезах на глубине 0.5 м в составе донной растительности преобладали водоросли, вегетирующие в течение одного года (Cladophora albida, Carradoriella denudata, Callithamnion corymbosum, Vertebrata subulifera, Brongniartella byssoides, Chondria dasyphylla, Ceramium virgatum), что также свидетельствует о влиянии осеннего шторма.
Сравнительный анализ состава и количественных показателей макрофи- тобентоса за 2017–2024 гг. на глубинах 1 и 3 м также выявил некоторые раз- личия. На разрезе 2 в 2017 г. в слое 1–3 м господствовала C. laetevirens, доля которой колебалась в диапазоне 66–78 %, при этом виды G. barbata и
E. crinita не были зарегистрированы, тогда как в 2024 г. вклад G. barbata до- стигал 41–82 % ОБМ (рис. 2). В течение исследуемого периода на разрезе 3 на глубине 1 м доля G. barbata была высокой и изменялась в диапазоне 85–100 % ОБМ (рис. 2). На разрезе 4 за этот период отмечено возрастание вклада G. barbata (с 46–60 до 82–87 %) и снижение доли морских трав (с 12–30 до 7–9 % ОБМ) (рис. 2). Показательно, что на разрезе 5 в 2024 г. донная рас- тительность была зафиксирована до глубины 3 м, тогда как в 2017 г. макро- фитобентос встречался только до глубины 1 м (табл. 2). За изучаемый период на глубине 1 м доля G. barbata и E. crinita была высокой и незначительно варьировала от 92 до 94 % ОБМ (рис. 2).
Анализ пространственно-временны́х изменений макрофитобентоса за по- чти полувековой период показал его существенную трансформацию. Так, по результатам гидроботанической съемки б. Севастопольской, состоявшейся в 1977 г., А. А. Калугина-Гутник показала, что в восточной части бухты на твердом субстрате на глубине 0.5–5 м преобладали в основном виды рода Ulva, а глубже, помимо этих видов, в составе макрофитобентоса встречались
G. barbata и E. crinita [26]. Характерно, что в начале XX в. в этой части бухты С. А. Зернов (1913) указывал на «чистые» заросли G. barbata и E. crinita 5). В кутовой части бухты (ее вершине), согласно ряду авторов, на протяжении более чем столетия на мягких грунтах отмечали скопления взморников (Zostera marina и Z. noltei) 5), 6). В 1977 г. в этой части бухты в составе высшей водной растительности были зарегистрированы еще и виды рода Ulva [26].
Согласно работе А. А. Калугиной-Гутник, в 1977 г. вдоль прибрежья у разрезов 1–3 на глубине 0.5 м встречались в основном виды рода Ulva (85–100
% ОБМ) (рис. 2) [26]. Позднее в статье И. К. Евстигнеевой и И. Н. Танковской было зафиксировано, что в 2003–2005 гг. на этой глубине в акватории разре- за 2 стали произрастать G. barbata и E. crinita [21]. Исследования, проведен- ные в 2017 г. на разрезах 1–3 на глубине 0.5 м, показали доминирование G. barbata и E. crinita, биомасса которых составляла 1412.4 ± 543.9, 1818.9 ±
476.2 и 3921.9 ± 776.2 г·м−2 соответственно (79, 55 и 97 % ОБМ).
На разрезе 1 в 1977 г. донная растительность распространялась до глуби- ны 3 м, где макрофитобентос был представлен почти чистыми скоплениями видов рода Ulva (95–100 % ОБМ). К 2017 г. произошло расширение верти- кального распространения макрофитов до глубины 5 м, при этом на горизон- те 1 м доминировала G. barbata (47 %), а на глубине 3–5 м преобладали виды рода Cladophora (60 % ОБМ) (рис. 2).
На разрезе 3 в 1977 г. на глубине 1 м, помимо видов рода Ulva, была от- мечена Zostera noltei, при этом характерно, что с увеличением глубины от 0.5 до 1 м доля видов рода Ulva снижалась с 85 до 56 %, а вклад Z. noltei возрас- тал с 15 до 40 % ОБМ (рис. 2) [26]. В 2017 г. показатель ОБМ значительно превысил значения за 1977 г., что связано с формированием почти монодо- минантных зарослей G. barbata (97–100 % ОБМ) (рис. 2).
Таким образом, анализ литературных источников и собственных данных о распределении макрофитобентоса в восточной части б. Севастопольской за почти полувековой период показал, что распространение и состав макро- фитобентоса значительно изменились. Наиболее существенная трансформа- ция растительной компоненты отмечена в кутовой части бухты, где произо- шла замена произрастающей здесь ранее высшей водной растительности (Zostera marina, Z. noltei, Stuckenia pectinata, Zannichellia sp., Ruppia sp.) на заросли многолетних водорослей (G. barbata и E. crinita). Эти изменения, вероятно, можно объяснить, во-первых, повышением солености воды в при- устьевой зоне р. Черной [23]. В работе [23] был сделан вывод, что в последние
Трансформация макрофитобентоса восточной части бухты характеризуется сменой доминирующих видов: ранее преобладавшие представители рода Ulva замещаются видами G. barbata и E. crinita, доля которых продолжает возрастать. На протяжении последних двух столетий Севастопольская бухта подвер- гается интенсивному антропогенному воздействию, что проявляется в повы- шении концентраций биогенных элементов в воде до уровней, на 1–2 порядка превышающих их содержание в открытых акваториях Черного моря [4–6, 10, 23]. Повышенные концентрации загрязняющих веществ в акватории бухты, включая ее восточный сектор, оказали значительное влияние на биотические компоненты, в частности на структуру донных фитоценозов. На всех иссле- дованных разрезах в восточной части бухты было зафиксировано обильное развитие зеленых водорослей, среди которых преобладали в основном
C. laetevirens, Ulva intestinalis L. и U. rigida – виды, являющиеся индикато- рами эвтрофирования акватории. Характерно, что эти водоросли, а также Callithamnion corymbosum, Ceramium virgatum, произрастают в воде, имею- щей высокий уровень загрязнения хозяйственно-бытовыми стоками.
В последние годы уделяется большое внимание природоохранным меро- приятиям, направленным на сокращение поступлений загрязняющих веществ в б. Севастопольскую, что, несомненно, отражается на экологической обста- новке акватории. Так, в работе Л. В. Малаховой с коллегами было показано, что в современных условиях в поверхностном слое донных осадков заре- гистрированы более низкие концентрации полихлорированных бифенилов (ПХБ 5), чем на глубине от 5 до 20 см, что свидетельствует о снижении техно- генного загрязнения бухты [12]. Возможно, улучшение качества среды прояви- лось в смене господствующих видов макрофитов. Так, в 2024 г. в изучаемой части бухты отмечено массовое произрастание G. barbata и E. crinita, встреча- ются Dictyota fasciola, Laurencia obtusa, Palisada perforata (Bory) K.W. Nam., Vertebrata subulifera. Известно, что обычно эти виды обитают на участках акватории, имеющей относительно невысокую степень эвтрофикации 2).
Выводы
- Гидроботанические исследования восточного сектора Севастопольской бухты в 2017 и 2024 гг. показали существенные изменения вертикального распределения макрофитобентоса при относительной стабильности видового состава доминирующих макрофитов. В настоящее время в составе донной растительности преобладают Gongolaria barbata и Ericaria crinita, также обильно представлены зеленые водоросли (Cladophora laetevirens, Ulva intestinalis, U. rigida). Характерно, что за этот период даже в кутовой части бухты заре- гистрировано возрастание вклада G. barbata (с 46–60 до 82–87 %) и снижение доли морских трав (с 12–30 до 7–9 % ОБМ).
- Показательно, что в 2024 г. почти на всех разрезах на глубине 0.5 м отмечено снижение ОБМ и доли G. barbata и E. crinita вследствие разру- шительного воздействия экстремального шторма, произошедшего осенью 2023 г., при этом на глубине 1 и 3 м количественные показатели биомассы макрофитобентоса были примерно вдвое выше, чем в 2017 г.
- Сравнительный анализ пространственного распределения макрофито- бентоса за 1977–2024 гг. выявил существенную трансформацию состава расти- тельной компоненты, наиболее выраженную в кутовой части бухты, где про- изошла полная смена ценозов высшей водной растительности (Zostera marina, Z. noltei, Stuckenia pectinata, Zannichellia sp., Ruppia sp.) на доминирующие заросли многолетних видов макрофитов (G. barbata и E. crinita). Эти измене- ния, вероятно, можно объяснить повышением солености воды в приустьевой зоне р. Черной, а также изменением динамики вдольбереговых потоков нано- сов. В восточной части бухты за этот период зафиксирована смена домини- рования видов рода Ulva на G. barbata и E. crinita, что, возможно, свидетель- ствует о тенденции к улучшению экологических условий.
1. The Value of the World's Ecosystem Services and Natural Capital / R. Costanza [et al.]// Nature. 1997. Vol. 387. P. 150–156. https://doi.org/10.1038/387253a0
2. Phillips R. C., Milchakova N. A. Seagrass ecosystems // Морской экологический журнал. 2003. Т. 2, № 2. P. 29–39. EDN UCBJDJ.
3. Extinction risk assessment of the world’s seagrass species / F. T. Short [et al.] // Biological Conservation. 2011. Vol. 144, iss. 7. P. 1961–1971. EDN OMTHDT. https://doi.org/10.1016/j.biocon.2011.04.010
4. О перспективах и возможностях оценки самоочистительной способности аквато- рии Севастопольской бухты / Е. Е. Совга [и др.] // Экологическая безопасность прибрежной и шельфовой зон и комплексное использование ресурсов шельфа. 2014. Вып. 28. С. 153–164. EDN VBFSTF.
5. Миньковская Р. Я., Вержевская Л. В. Оценка качества воды рек Севастопольского региона для определения антропогенной нагрузки на прибрежную часть моря // Экологическая безопасность прибрежной и шельфовой зон моря. 2016. № 2. С. 93–101. EDN WKTQRF.
6. Совга Е. Е., Мезенцева И. В., Хмара Т. В. Природно-климатические и антропогенные факторы, определяющие самоочистительную способность морских мелководных экосистем в отношении восстановленных форм азота // Экологическая безопасность прибрежной и шельфовой зон моря. 2021. № 3. С. 23–36. EDN YUWVPQ. https://doi.org/10.22449/2413-5577-2021-3-23-36
7. Слепчук К. А., Совга Е. Е. Уровень эвтрофирования восточного района Севастопольской бухты по результатам численного моделирования индекса E-TRIX // Экологическая безопасность прибрежной и шельфовой зон моря. 2018.№ 2. С. 53–59. EDN YLLQLJ. https://doi.org/10.22449/2413-5577-2018-2-53-59
8. Локальные изменения физико-биологических параметров поверхностных вод Севастопольской бухты под влиянием ливневого стока / А. В. Багаев [и др.] // Морской гидрофизический журнал. 2022. Т. 38, № 2. С. 165–184. EDN DTNJVC. https://doi.org/10.22449/0233-7584-2022-2-165-184
9. Орехова Н. А., Коновалов С. К., Овсяный Е. И. Изменение геохимических харак- теристик в донных осадках Крымского побережья // Экологическая безопасность прибрежной и шельфовой зон моря. 2013. Вып. 27. С. 284–288. EDN VBFRZZ.
10. Орехова Н. А., Медведев Е. В., Овсяный Е. И. Влияние вод реки Черной на гидрохимический режим Севастопольской бухты (Черное море) // Экологическая безопасность прибрежной и шельфовой зон моря. 2018. № 3. С. 84–91. EDN YLLQIH. https://doi.org/10.22449/2413-5577-2018-3-84-91
11. Миронов О. Г., Кирюхина Л. Н., Алемов С. В. Санитарно-биологические аспекты экологии севастопольских бухт в ХХ веке. Севастополь : ЭКОСИ-Гидрофизика, 2003. 185 с. EDN XXFQVL.
12. Малахова Л. В., Малахова Т. В., Егоров В. Н. Донные отложения морской аквато- рии и пресных водоемов Крыма как депо стойких органических загрязнителей // «Ломоносовские чтения–2019» : ежегодная научная конференция МГУ. Севасто- поль, 3–4 апреля 2019 г. Севастополь : Филиал МГУ в г. Севастополе, 2019. С. 209–210. EDN RYQMKJ.
13. Полициклические ароматические углеводороды в донных отложениях зоны сме- шения река – море на примере реки Черной и Севастопольской бухты (Черное море) / О. В. Соловьёва [и др.] // Морской гидрофизический журнал. 2021. Т. 37, № 3. С. 362–372. EDN VYHDOC. https://doi.org/10.22449/0233-7584-2021-3-362-372
14. Чекалов В. П. Соотношение процессов аэробной и анаэробной деструкции органического вещества в донных отложениях прибрежных акваторий Крыма (Чёрное море) // Морской биологический журнал. 2023. Т. 8, № 3. С. 87–96. EDN ZSYRFI.
15. Особенности пространственного распределения нефтяных углеводородов и струк- туры макрозообентоса бухт Севастопольская и Варна / Т. С. Осадчая [и др.] // Системы контроля окружающей среды. Севастополь, 2010. Вып. 13. С. 247–255. EDN ZTYQFF.
16. Витер Т. В. Донные сообщества в районе причалов б. Голландия и в районе ГРЭС (б. Севастопольская) // Экологическая безопасность прибрежной и шельфовой зон моря. 2013. Вып. 27. С. 431–438. EDN VBFSKT.
17. Макаров М. В., Витер Т. В. Пространственно-временные изменения в макрозообен- тосе устья реки Черной и вершины Севастопольской бухты (Юго-Западный Крым) // Ученые записки Крымского федерального университета имени В. И. Вер- надского. Биология. Химия. 2021. Т. 7, № 4. С. 92–107. EDN SVHKYE.
18. Гусева Е. В., Алёмов С. В. Мейобентос Севастопольской бухты (Черное море): современное состояние и многолетние изменения // Экологическая безопасность прибрежной и шельфовой зон моря. 2022. № 1. С. 104–112. EDN NVOFQH. https://doi.org/10.22449/2413-5577-2022-1-104-112
19. Александров В. В. Оценка состояния ценопопуляций Zostera marina в районе Севастополя // Экология моря. 2000. Вып. 52. С. 26–30. EDN WIAELJ.
20. Александров В. В. Морфоструктура особей Potamogeton pectinatus в районе Сева- стополя (Черное море) // Экология моря. 2005. Вып. 68. С. 13–18. EDN UMCMAX.
21. Евстигнеева И. К., Танковская И. Н. Современное состояние и изменчивость макрофитобентоса ботанического памятника природы «Ушакова балка» (Черное море, Севастопольский регион) // Современные проблемы экологии Азово- Черноморского региона : материалы IV Международной конференции. 8–9 ок- тября 2008, Керчь. Керчь : Изд-во ЮгНИРО, 2008. C. 92–98.
22. Евстигнеева И. К., Танковская И. Н. Видовой состав, экологическая структура и количественная характеристика макроводорослей бухты Голландия (Черное мо- ре) // Вопросы современной альгологии. 2017. № 1. 7. EDN ZCDLIZ.
23. Совга Е. Е., Хмара Т. В. Влияние стока реки Черной в периоды паводка и межени на экологическое состояние кутовой части акватории Севастопольской бухты // Морской гидрофизический журнал. 2020. Т. 36, № 1. С. 31–40. EDN NNGSDX. https://doi.org/10.22449/0233-7584-2020-1-31-40
24. Горячкин Ю. Н., Долотов В. В. Морские берега Крыма. Севастополь : Колорит, 2019. 256 с. EDN ARVKTY.
25. Акватория и берега Севастополя: экосистемные процессы и услуги обществу / Под ред. Е. В. Павловой и Н. В. Шадрина. Севастополь : Аквавита, 1999. 290 с.
26. Калугина-Гутник А. А. Изменения в донной растительности Севастопольской бухты за период с 1967 по 1977 г. // Экология моря. 1982. Вып. 9. С. 48–62. EDN ZBPSLT.
27. Экстремальный черноморский шторм в ноябре 2023 года / В. А. Дулов [и др.] // Морской гидрофизический журнал. 2024. Т. 40, № 2. С. 325–347. EDN ESLTYQ.
28. Ефремова Т. В., Горячкин Ю. Н. Морфодинамика севастопольских бухт под воздействием антропогенной деятельности // Экологическая безопасность прибрежной и шельфовой зон моря. 2023. № 1. С. 31–47. EDN THAAMX. https://doi.org/10.29039/2413-5577-2023-1-31-47
















