Россия
Россия
Россия
Россия
Севастопольское взморье испытывает постоянное воздействие антропогенных и при- родных факторов, которое может усиливаться в закрытых бухтах. Цель работы – проанализировать пространственно-временну́ ю изменчивость гидролого-гидрохимических параметров и состояние планктонных сообществ Севастопольского взморья в современный период. Исследования изменчивости гидрохимических показателей вод, фитопланктона и меропланктона проведены в 2020–2022 гг. в бухтах Камышовой, Казачьей, Круглой, Стрелецкой, Севастопольской и Карантинной. Гидрохимические показатели (соленость, биохимическое потребление кислорода за пять суток (БПК5), перманганатная окисляемость, содержание кремния, минеральных и органических форм азота и фосфора) определяли по общепринятым методикам. Для определения лимитирующего биогенного фактора использовали стехиометрические соотношения Редфилда. Определяли видовой состав, численность и биомассу фитопланктона и ме- ропланктона. За 20 лет на взморье Севастополя отмечено повышение уровня загряз- нения поверхностных вод (БПК5 и окисляемость превышали предельно допустимые значения). Биогенные элементы (соединения азота, фосфора, кремния) изменялись в широких пределах. Лимитирующим фактором для развития фитопланктона в ве- сенний период был азот, летом – кремний, летом и осенью – фосфор. За период ис- следования не зафиксировано случаев «цветения» фитопланктона. Массовое разви- тие диатомовых водорослей и кокколитофорид отмечено в весенний период. Летом и осенью численность и биомасса планктонных микроводорослей снижались до ми- нимальных значений. Отмечена относительная синхронность сезонной динамики плотности меропланктона: во всех бухтах Севастополя минимальные значения заре- гистрированы в холодный период года, максимальные – в теплый период при про- греве воды выше 14.5 °С. Сравнительный анализ и количественные оценки динамики планктона в бухтах, различающихся по гидрологическим и гидрохимическим пара- метрам среды, могут внести вклад в оценку функциональной реакции прибрежных экосистем Черного моря на антропогенные и природные факторы.
фитопланктон, меропланктон, биогенные элементы, биохимиче- ское потребление кислорода, БПК5, Черное море
Введение
Основой пелагических пищевых цепей в водных системах является фи- топланктон, на динамику численности, видовое разнообразие и продуктив- ность которого влияют различные факторы окружающей среды. В связи с этим структурные и функциональные параметры фитопланктона могут служить индикаторами изменений в экосистемах бухт. Одним из звеньев трофической цепи в экосистеме пелагиали является меропланктон (пелагические личинки донных беспозвоночных). С одной стороны, личинки потребляют большое количество фитопланктона, с другой – они сами входят в состав пищи многих морских беспозвоночных и рыб. При этом меропланктон наиболее уязвим для воздействия различного рода токсикантов и хозяйственно-бытовых стоков [1].
Севастопольское взморье испытывает значительное воздействие антро- погенных факторов, которое может усиливаться в закрытых бухтах [2, 3]. Бухты имеют различную конфигурацию, размеры и глубину. Большинство из них вытянуты и вдаются глубоко в берег (Севастопольская, Карантинная, Стрелецкая, Камышовая и Казачья), исключение составляет б. Круглая [4]. На формирование гидрохимического режима Севастопольского взморья ока- зывают влияние речной, хозяйственно-бытовой и ливневый стоки с высоким содержанием минерального азота, превышающим на один – три порядка со- держание соединений фосфора и определяющим эвтрофирование водоемов [2]. Влияние речного стока и антропогенного загрязнения возрастает с запада на восток. Наиболее неблагополучной является б. Карантинная, наименее – б. Казачья. В то же время исследования, выполненные в отдельных бухтах Се- вастопольского взморья в последние годы, свидетельствуют о появлении но- вых очагов антропогенного загрязнения и существенном увеличении со- держания общего взвешенного и растворенного органического вещества и нефтяных углеводородов, которое часто превышало предельно допустимую концентрацию (ПДК) [5–7].
Цель работы – проанализировать пространственно-временну́ ю изменчи- вость гидролого-гидрохимических параметров и состояние планктонных сообществ Севастопольского взморья по данным 2020–2022 гг.
Материалы и методы
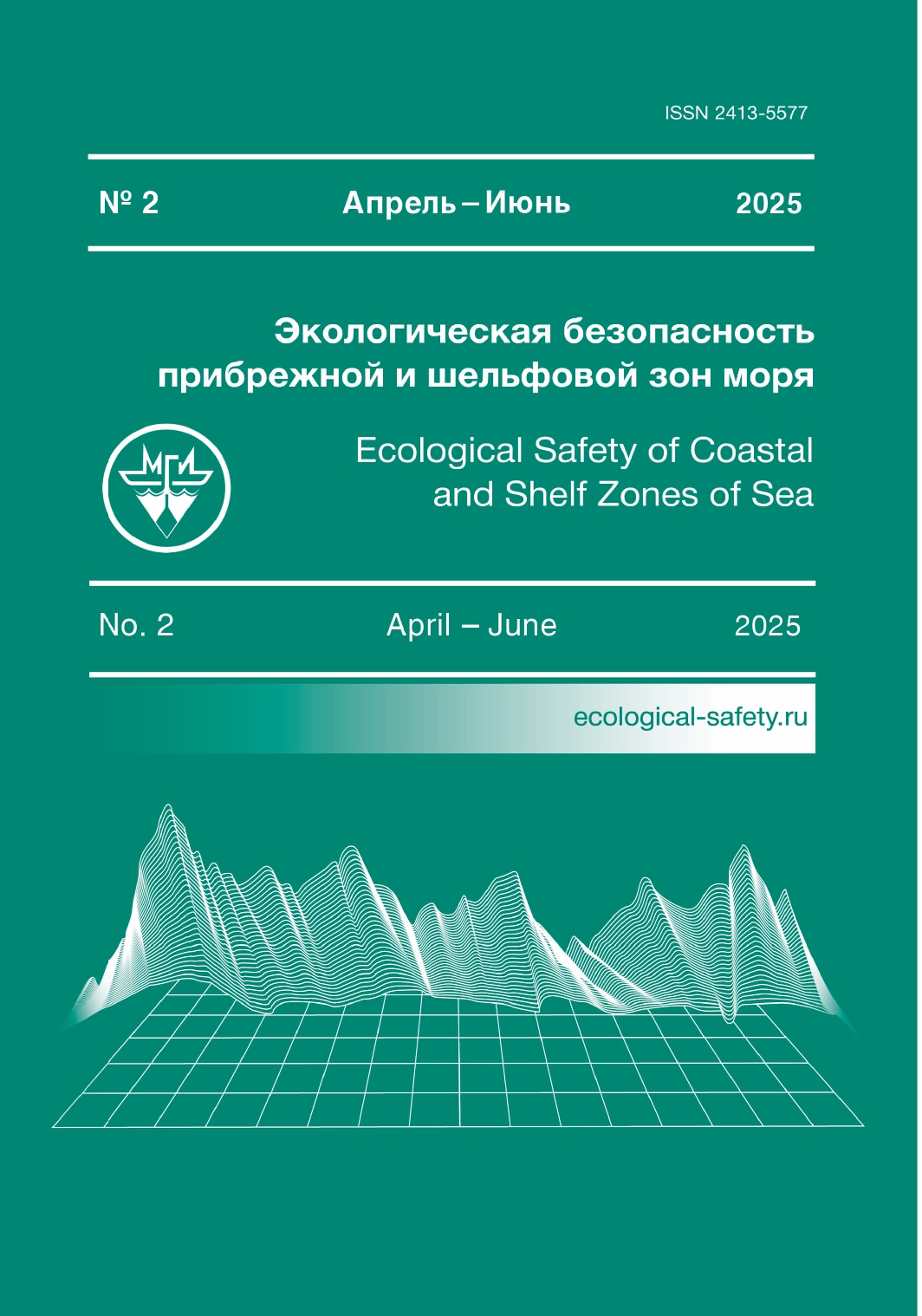
Исследования проведены с октября 2020 по ноябрь 2022 г. Всего выпол- нено шесть однодневных съемок: весной (май 2021 г.), летом (июль 2021 г., август 2022 г.) и осенью (октябрь 2020 г., ноябрь 2021 и 2022 гг.). Пробы от- бирали на траверзе бухт Камышовой (ст. 1), Казачьей (ст. 2), Круглой (ст. 1), Стрелецкой (ст. 4), Карантинной (ст. 6) и Севастопольской (ст. 7), а также на станции в открытой части взморья (ст. 5), удаленной от берега на 2 км (рис. 1). Глубина в районе исследований составляла в основном 12–20 м, за ис- ключением контрольной станции (ст. 5), где она достигала 50 м.
Р ис . 1. Карта-схема района исследований (1–7 – номера стан- ций). Источник: Google Maps (URL: https://www.google.ru/maps)
F ig . 1. A map-scheme of the study area (1–7 are station numbers). Adopted from Google Maps (URL: https://www.google.ru/maps)
Пробы отбирали в поверхностном и придонном слоях с помощью бато- метра БМ-48М. Определяли соленость (электросолемер ГМ-65 с регулярной калибровкой титрованием раствором AgNO3), биохимическое потребление кислорода за пять суток (БПК5), перманганатную окисляемость в щелочной среде, содержание кремния, а также минеральных и органических форм азота и фосфора по общепринятым методикам 1), 2). Для определения лимитирующего биогенного фактора использовали стехиометрические соотношения Редфилда (РRat) 3), которые для известных концентраций неорганических соединений азота, фосфора и кремния имели следующий вид:
РRat (N/P) = 1.53 (1.35 NO2 + NO3 + 3.44 NH4) / PO4, РRat (Si/N) = SiO4 / (1.47 (1.37 NO2 + NO3 + 3.77 NH4)), РRat (Si/P) = 1.03 SiO4/PO4.
Для определения видового состава, численности и биомассы фитопланк- тона пробы (V = 2.0 л) отбирали из верхнего слоя морской воды (0–1 м). Мор- скую воду фильтровали через ядерно-трековые мембраны с диаметром пор 1 мкм (Объединенный институт ядерных исследований, Дубна) на установке обратной фильтрации, концентрировали до объема 40–50 мл и фиксировали раствором Утермеля. Видовую идентификацию микроводорослей проводили с использованием светового микроскопа при увеличении 200× и 400× (Olympus BX43) с помощью определителей 4), 5). Численность и биомассу фитопланктона рассчитывали с использованием компьютерной программы «Глория», разрабо- танной в ИнБЮМ [8]. Таксономические названия приведены в соответствии с базами данных AlgaeBase (URL: https://www.algaebase.org) и Всемирного ре- естра морских видов (URL: https://www.marinespecies.org).
Отбор проб меропланктона в период исследований выполнен на прибреж- ных станциях с глубиной до 13 м. Материал собирали сетью Джеди с диамет- ром входного отверстия 36 см и размером ячеи мельничного газа 135 мкм. Облавливали слой воды 0–10 м от дна до поверхности. Обработку проводили на живом материале путем тотального подсчета личинок в камере Богорова под бинокуляром МБС-9; для уточнения видовой принадлежности личинок использовали световой микроскоп Микмед-5 [3].
Всего было обработано и проанализировано 96 проб для гидролого-гидро- химического анализа и по 23 пробы фито- и меропланктона.
Математические и статистические расчеты проводили в программе Excel 2016. Получены оценки минимальных, максимальных, средних значений и стандартных отклонений.
Результаты
Пространственно-временно́е распределение термохалинных и гидрохи- мических параметров
Температура и соленость. Температура поверхностного слоя изменялась от 14.4 (май) до 26.1 °С (август), снижаясь в результате осеннего выхолажи- вания до 13.1 °С (ноябрь). В период формирования термоклина (май – август) наблюдалось расслоение вод: максимальная разность температур поверхност- ного и придонного слоев на контрольной станции достигала 16.2 °С, а на мел- ководной станции (б. Камышовая) расслоение было минимальным, разница температуры не превышала 0.9 °С. Осенью в результате конвективного пере- мешивания температура выравнивалась по вертикали.
Пространственная структура термохалинных полей поверхностного слоя характеризовалась незначительными градиентами. Так, диапазон изменчиво- сти температуры поверхностного слоя морской воды составил 0.3–1.4 °С, а солености – 0.08–0.21 ЕПС. Следует отметить повышение солености на кон- трольной станции по сравнению с бухтами. Экстремально низкие значения солености отмечены в ноябре 2021 г. (17.63–17.84 ЕПС), в периоды других съемок значения солености поверхностного слоя менялись в диапазоне 18.02–
18.54 ЕПС. Соленость увеличивалась от поверхности ко дну, максимальная раз- ность значений солености зафиксирована в слое 0–50 м (0.42 ЕПС 17.11.2021 и 0.33 ЕПС 09.07.2021).
БПК5 и окисляемость. Значения БПК5 изменялись в широком диапазоне 0.57–3.87 мг/дм3 (таблица). Показатели, близкие к нормативам качества воды водных объектов рыбохозяйственного значения и превышающие их (2.1 мг/дм3 и более), были отмечены весной (б. Камышовая, Круглая, Каран- тинная, Севастопольская) и в летние съемки (б. Камышовая, Казачья, Круг- лая, Стрелецкая). При этом в осенний период значения БПК5 не превышали нормативных значений на всех станциях, за исключением съемки осенью 2021 г. на станции в б. Камышовой (3.84 мг/дм3).
Значения окисляемости в период наблюдений изменялись от 1.62 до
5.49 мгО/дм3 (таблица). Превышение норматива этого показателя (более
4.0 мгО/дм3) было отмечено во всех бухтах и в разные сезоны года. Средние значения окисляемости за период наблюдений по бухтам были ниже норма- тивов качества воды.
Биогенные элементы. Концентрация нитритного азота (NO2) была низкой и не превышала 3.5 мкг/дм3 в поверхностном слое (таблица) и 4.6 мкг/дм3 в придонном (б. Стрелецкая). Концентрация нитратов в поверхностном слое изменялась от 4.6 (май 2021 г., б. Севастопольская) до 267.5 мкг/дм3 (август 2022 г., б. Карантинная). В придонном слое концентрация нитратов менялась от 3.8 до 86.8 мкг/дм3 (август 2022 г.). Средние значения нитратов в по- верхностном слое по бухтам менялись от 12.7 в б. Круглой до 58.1 мкг/дм3 в б. Карантинной. Следует отметить съемку в августе 2022 г., когда высо- кие показатели нитратов были зафиксированы на всех станциях и достигали
267.5 мкг/дм3 в поверхностном слое б. Карантинной. Повышенные значения концентрации в этой же съемке зафиксированы также и в придонном слое (39–59 мкг/дм3), а максимум (86.8 мкг/дм3) зафиксирован на контрольной стан- ции у дна. Концентрация азота аммонийного на Севастопольском взморье была низкой и находилась в пределах от 0.6 мкг/дм3 (б. Круглая, май 2021 г.) до 32.4 мкг/дм3 (б. Камышовая, август 2022 г.). В августе 2022 г. отмечена повышенная концентрация NH4 на всех станциях. Концентрация азота орга- нического (Nорг) менялась в широком диапазоне: от 331 мкг/дм3 в мае 2020 г. до 1375 мкг/дм3 в б. Стрелецкой в августе 2022 г. (таблица). Высокие значе- ния концентрации Nорг были зафиксированы также в б. Круглой, Казачьей и Камышовой.
Концентрация фосфора минерального (РО4) изменялась в пределах от 1.1 до 15.9 мкг/дм3. Минимальное содержание отмечено осенью 2022 г. на кон- трольной станции, максимальное – весной 2021 г. в б. Камышовой (таблица). Среднее значение РО4 по акватории Севастопольского взморья за 2020–2022 гг. составляет 6.3 мкг/дм3. Содержание фосфора органического (Рорг) изменялось от 3.7 до 34.9 мкг/дм3. Максимальные значения отмечены в летний период в б. Казачьей. Средние значения Рорг за весь период исследований изменялись в диапазоне от 15.3 до 22.1 мкг/дм3. В целом значения концентрации Рорг бы- ли низкими и однородными. Сезонной изменчивости не отмечено.
Гидрохимические показатели в поверхностном слое на исследуемой акватории (2020–2022 гг.)
Hydrochemical parameters in the surface layer of the water area under study (2020–2022)
|
Бухта / Bay |
Значе- ние / Value |
БПК5, мг/дм3 / BOD5, mg/dm3 |
Окисля- емость, мгО/дм3 / PI, mgO/dm3 |
Содержание, мкг/дм3 / Content, μg/dm3 |
||||||
|
NO2 |
NO3 |
NH4 |
Nорг / Norg |
РО4 |
Рорг / Porg |
Si |
||||
|
Казачья / Kazachya |
среднее / mean 1.63 3.23 0.9 24.3 8.7 696 4.0 17.8 44.5 min 0.70 1.75 0.4 4.7 2.1 378 1.4 3.7 12.4 max 2.72* 4.37 1.3 90.3 15.0 1131 12.3 34.9 72.6 |
|||||||||
|
Камышовая / Kamyshovaya |
среднее / mean 2.61 3.92 1.3 24.6 13.5 645 6.5 21.0 60.3 min 1.31 2.30 0.9 5.3 1.7 331 2.4 5.0 14.8 max 3.87 5.49 1.6 70.4 32.4 1188 15.9 26.7 98.6 |
|||||||||
|
Круглая / Kruglaya |
среднее / mean 1.40 3.24 0.8 12.7 8.2 645 3.7 17.6 40.0 min 0.57 2.01 0.1 5.4 0.6 372 1.4 4.3 17.9 max 2.23 4.11 1.2 44.5 17.4 1235 10.9 26.4 63.7 |
|||||||||
|
Стрелецкая / Streletskaya |
среднее / mean 1.38 3.37 1.4 24.2 8.6 660 3.9 19.2 81.2 min 0.60 1.98 0.7 5.1 1.8 412 1.1 4.1 23.8 max 2.21 4.50 2.1 40.9 19.1 1375 10.5 33.4 118.1 |
|||||||||
|
Карантинная / Karantinnaya |
среднее / mean 1.43 3.22 1.4 58.1 8.8 545 5.1 17.1 64.8 min 0.66 1.62 0.8 6.5 1.9 411 1.8 4.6 15.1 max 2.72 4.73 3.5 267.5 17.8 824 11.5 27.3 152.4 |
|||||||||
|
Севастополь- ская / Sevastopol |
среднее / mean 1.45 3.51 1.7 14.1 8.7 670 6.3 22.1 47.4 min 1.10 2.39 1.2 4.6 2.6 459 3.5 15.0 19.8 max 2.32 4.63 2.3 22.2 12.9 838 11.2 34.2 75.0 |
|||||||||
|
Контроль / Control |
среднее / mean 1.50 3.89 0.8 14.3 7.7 618 4.2 22.8 31.0 min 1.26 3.28 0.5 6.5 2.2 370 1.8 14.2 14.3 max 2.02 4.42 1.0 29.1 13.6 801 9.5 29.1 58.7 |
|||||||||
П р и м е ч а н и е . Жирным шрифтом выделены значения, превышающие ПДК 2) и нормативы качества воды водных объектов рыбохозяйственного значения 2). ПДК NO2 – 20 мкг/дм3, NO3 – 9000 мкг/дм3, NH4 – 390 мкг/дм3. Нормативные значения БПК5 – не более 2.1 мкг/дм3, окисляемости – 4.0 мкг/дм3.
N o te . Values exceeding maximum permissible concentrations (MPC) 2) and limits for water quality of fisheries 2) are given in bold. PI – permanganate index. MPC of NO2 – 20 μg/dm3, NO3 – 9,000 μg/dm3, NH4 – 390 μg/dm3. BOD5 limit value – under 2.1 μg/dm3, PI limit value – 4.0 μg/dm3.
Содержание кремния (Si) отличалось большой изменчивостью. Так, в поверхностном слое концентрация Si менялась в пределах от 12.4 мкг/дм3 (июль 2021 г.) в б. Казачьей до 152.4 мкг/дм3 (август 2022 г.) в б. Карантинной (таблица). Высокие значения концентрации Si зафиксированы во всех бухтах в августе 2022 г. как в поверхностном (64–152 мкг/дм3), так и в придонном слое (100–153 мкг/дм3). Сезонной изменчивости концентрации кремния не отмечено.
Соотношение биогенных элементов
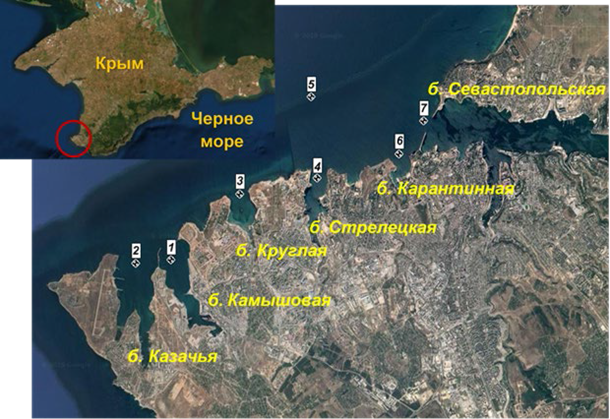
Результаты расчетов отношения Редфилда (РRat) для азота, фосфора и крем- ния с целью определения лимитирующего фактора для фитопланктона пред- ставлены на рис. 2. Наблюдался широкий диапазон относительных значений N/P – от 1 до 53. Минимальные значения отмечены в весенний период (1–3), что свидетельствует о значительном ограничении азота. Соотношение было близко к классическому коэффициенту Редфилда в летний период (за исклю- чением б. Казачьей и Карантинной), осенью 2020 г. в б. Карантинной и Севастопольской и осенью 2021 г. в б. Камышовой. В других случаях соот- ношение значений N/P превышало 16, что соответствовало ограничению, вы- званному фосфором.
Соотношение Si/N варьировало от 0.2 до 21. Значение Si/N более едини- цы отмечено в весенний период, а также осенью 2020 г. в б. Стрелецкой. Соотношение Si/P изменялось от 3 до 56. В осенний период 2020 и 2021 г. это соотношение превышало классические значения. В весенне-летний период наблюдались пониженные значения соотношения Si/P.
С учетом соотношения всех трех элементов (N/Si/P) значения, близкие к классическому соотношению Редфилда, наблюдались только осенью 2020 г. в б. Карантинной (18/17/1). В остальное время отмечались существенные от- клонения.
Фитопланктон: динамика таксономического состава и плотности
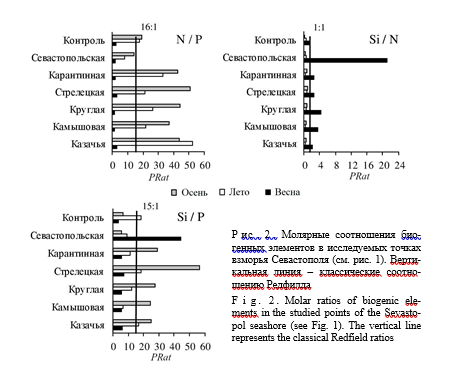
Всего в пробах фитопланктона отмечено 75 видов микроводорослей, из которых 35 относятся к диатомовым, 32 – к динофитовым. Остальные ви- ды относятся к отделам Haptophyta, Euglenozoa, Ochrophyta, Cercozoa. Мак- симальные значения численности и биомассы фитопланктона во всех бухтах отмечены в весенний период (рис. 3). Исключение составил осенний период 2020 г. в б. Севастопольской, когда биомасса планктонных микроводорослей превышала 400 мг·л−1, численность фитопланктона при этом была низкой. В летний и осенний период 2021 г. обилие фитопланктона было низким.
Пространственно-временна́я изменчивость численности основных групп фитопланктона свидетельствует о высокой вариабельности состава сообще- ства. Осенью 2020 и 2021 гг. отмечено абсолютное доминирование диатомо-
вых водорослей как по численности (75–100 %), так и по биомассе (64–100 %). В весенний период диатомовые с кокколитофоридами преобладали по числен- ности (98–99 %) в б. Камышовой, Круглой и Севастопольской, по биомассе – на всех станциях. Летом диатомовые доминировали по численности (52– 80 %), но уступали динофлагеллятам (57–91 %) по биомассе. Осенью 2020 г. на всех станциях основной вклад (57–97 %) в суммарную численность и био- массу вносила крупноклеточная диатомовая водоросль Proboscia alata, а осе- нью 2021 г. – Pseudosolenia calcar-avis (87–99 %). Почти на всех станциях в мае
Р и с . 3 . Суммарные значения численности N (a) и биомассы B (b) фитопланктона на станциях в бухтах Севастополя (см. рис. 1)
F i g. 3. The total abundance N (a) and biomass B (b) of phytoplank- ton in Sevastopol bays (see Fig. 1)
2021 г. доминировала кокколитофорида Emiliania huxleyi (37–58 % от суммар- ной численности), а в б. Камышовой наряду с кокколитофоридами значи- тельный вклад в численность вносили диатомовые Pseudo-nitzschia calliantha и Chaetoceros wighamii (23 и 45 % от суммарной численности соответственно).
Основу биомассы (40–58 % от суммарной) весеннего фитопланктона во всех бухтах составила P. alata. В летний период в б. Казачьей и Стрелец- кой пики численности давали динофитовые рода Prorocentrum. В б. Камышо- вой диатомовые Chaetoceros tortissimus, Leptocylindrus danicus и P. alata со- ставили более 68 % общей численности, в б. Круглой доминировали диато- мовые P. calliantha и P. alata (более 50 % общей численности). Основу био- массы формировали крупноклеточная диатомовая P. alata и динофлагелляты рода Prorocentrum.
Меропланктон: динамика таксономического состава и плотности
В период исследований в планктоне идентифицированы личинки 41 вида донных беспозвоночных, относящихся к следующим таксонам: тип Annelida, класс Polychaeta – 16 видов; тип Mollusca, классы Bivalvia – 7, Gastropoda – 9 видов; тип Arthropoda, подтип Crustacea: инфракласс Cirripedia – 2 вида и от- ряд Decapoda – 7 видов. Единично встречались не идентифицированные до ви- да планулы Coelenterata (Тип Cnidaria), личинки Kamptozoa (Тип Entoprocta) и Bryozoa (Тип Bryozoa).
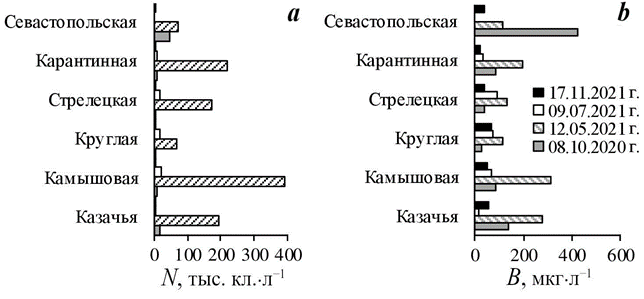
На всей акватории Севастопольского взморья минимальное количество личинок донных беспозвоночных зафиксировано в холодный период года. В ноябре 2021 г. суммарная плотность меропланктона не превышала 29 экз/м3 (рис. 4). В планктоне встречались великонхи двустворчатых моллюсков ми- дии Mytilus galloprovincialis Lamarck, 1819 и спизулы Spisula subtruncata (Da Costa, 1778), не идентифицированные до вида велигеры брюхоногих моллюс- ков, личинки многощетинковых червей (Spio decorata Bobretzky, 1870) и нау- плиусы усоногого рака Amphibalanus improvisus (Darwin, 1854).
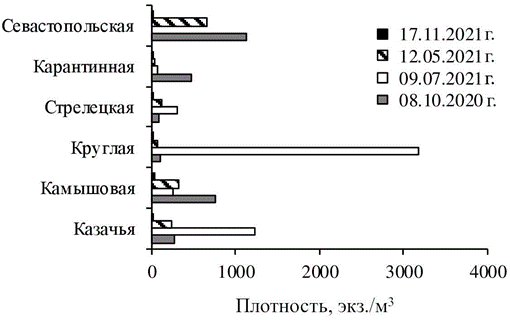
Р ис . 4 . Динамика плотности меропланк- тона в бухтах Севастополя (см. рис. 1)
F i g. 4. Dynamics of meroplankton density in Sevastopol bays (see Fig. 1)
Существенное увеличение количества личинок в планктоне отмечено в теплый период года, когда начинали размножаться многие виды донных беспозвоночных. В мае максимальная плотность меропланктона (661 экз/м3) зарегистрирована в б. Севастопольской, в б. Камышовой она достигала 322 экз/м3), тогда как в остальных районах колебалась от 26 экз/м3 (в б. Ка- рантинной) до 227 экз/м3 (в б. Казачьей) (рис. 4).
Видовой состав меропланктона стал более разнообразен. Из моллюсков, кроме личинок мидии, в планктоне появились великонхи двустворчатых мол- люсков семейства Cardiidae, велигеры брюхоногих моллюсков семейства Rissoidae. Плотность личинок мидий была невысока – до 15 экз/м3, тогда как плотность велигеров Gastropoda достигала 147 экз/м3 (в б. Камышовой). В планктоне появились личинки многощетинковых червей Harmothoe reticulata (Claparède, 1870), Pholoe inornata Johnston, 1839, Polydora cornuta Bosc, 1802, Alitta succinea (Leuckart, 1847) и не идентифицированные до вида личинки се- мейства Nereididae. Единично отмечены личинки Decapoda (Hippolyte leptocerus (Heller, 1863), Upogebia pusilla (Petagna, 1792)). По численности во всех бухтах доминировали личинки усоногого рака A. improvisus – с максимумом 597 экз/м3 (в б. Севастопольской) до 227 экз/м3 (в б. Казачьей).
В июле максимальная плотность меропланктона (3180 экз/м3) была отме- чена в б. Круглой из-за высокой плотности личинок брюхоногих моллюсков (2173 экз/м3). В планктоне доминировали велигеры биттиума (Bittium reticulatum (Da Costa, 1778) и представителей семейства Rissoidae. Тогда как в других бухтах их плотность не превышала 135 экз/м3 и только в б. Казачьей достигала 373 экз/м3. В этот период во всех бухтах отмечено и увеличение плотности личинок усоногих раков, но преобладали в планктоне науплиусы другого вида – Verruca spengleri Darwin, 1854.
В октябре плотность меропланктона была выше в б. Севастопольской и Камышовой – до 1126 и 756 экз/м3 соответственно (рис. 4). При этом коли- чество личинок в остальных бухтах колебалось от 91 экз/м3 (в б. Стрелецкой) до 463 экз/м3 (в б. Карантинной). По численности преобладали велигеры брюхоногих моллюсков (Retusa truncatula (Bruguière, 1792), Caecum trachea (Montagu, 1803), Limapontia capitata (O. F. Müller, 1774), Rissoa parva (Da Costa, 1778), Rissoa sp.). Их максимальная суммарная плотность (235 экз/м3) заре- гистрирована в б. Камышовой. В этот период отмечено также увеличение количества личинок мидии M. galloprovincialis, находящихся на стадии вели- конха «с глазком». В б. Камышовой их плотность составляла 110 экз/м3, в остальных районах исследования плотность личинок мидий колебалась от 9 до 62 экз/м3. Плотность личинок полихет не превышала 29 экз/м3, встреча- лись Lysidice ninetta Aud. et H. M. Edw., 1833 Magelona rosea Moore, 1907, Malacoceros fuliginosus (Claparède, 1870) и не определенные до вида Prionospio sp. и Phyllodoce sp. Науплиусы усоногого рака A. improvisus (до 782 экз/м3) преобладали в б. Севастопольской. В октябре в планктоне зарегистрированы личинки десятиногих раков (Clibanarius erythropus (Latreille, 1818), Pisidia longimana (Risso, 1816), Xantho poressa (Olivi, 1792), Pachygrapsus marmoratus (Fabricius, 1787), Athanas nitescens (Leach, 1813), но их суммарная плотность не превышала 30 экз/м3 (отмечена в б. Карантинной).
Динамика плотности меропланктона во всех бухтах была относительно синхронна – минимальные значения (до 29 экз/м3) характерны для холодного периода года с температурой воды 14.5 °С (ноябрь), увеличение плотности отмечено при прогреве воды (май, июль, октябрь). В мероплантоне по чис- ленности преобладали науплиусы усоногого рака Amphibalanus improvisus: в холодный период года они встречались единично, а в мае и октябре доми- нировали в планктоне, что влияло на суммарные показатели плотности меро- планктона в этот период. Максимальное количество личинок балянусов заре- гистрировано в б. Севастопольской и Камышовой.
Обсуждение
Представляет интерес сравнение гидролого-гидрохимических данных, полученных нами по одной схеме станций в 2001–2005 гг. и 2020–2022 гг. [2]. В 2020–2022 гг. отмечено повышение солености в поверхностном слое на ис- следуемой акватории. В 2001–2005 гг. средние значения солености варьиро- вали от 17.70 до 17.94 ЕПС [2], тогда как в 2020–2022 гг. соленость достигала
18.54 ЕПС. На тренд увеличения солености в прибрежье Севастополя в по- следние годы указывают и другие авторы [3, 9]. Положительный тренд соле- ности в поверхностном слое обнаружен за период с 2001 по 2018 г. в б. Ка- рантинной [9]. Исследования в шельфовой зоне северо-восточной части Чер- ного моря также показали поступательное увеличение солености в верхнем 200-метровом слое моря с 2010 по 2020 г. [10]. Авторы связывают это прежде всего с колебаниями климатического режима Черного моря.
По официальным данным Крымстата (URL: https://82.rosstat.gov.ru/), чис- ленность населения г. Севастополя за последние 20 лет увеличилась на 33 %, тогда как фактически, по оценкам правительства, этот показатель превышает 40 %. Отмечено расширение площади городской застройки в прибрежной зоне, соответственно увеличился объем хозяйственно-бытовых вод и нагруз- ка на очистные сооружения. Кроме того, с повышением урбанизации увели- чивается объем ливневых стоков и ухудшается их качество [5, 11]. Все это приводит к повышению концентрации минеральных и органических веществ в прибрежной акватории и влияет на уровень загрязнения поверхностных вод, который мы оценивали по двум показателям – БПК5 и окисляемости. Первый показатель отражает загрязнение среды нестойким органическим веществом, второй свидетельствует о степени загрязнения стойким органиче- ским веществом. Средние значения БПК5, полученные до 2005 г. на взморье Севастополя, не превышали 0.79 мг/дм3 [2], тогда как в современный период значения БПК5 превышали нормативы качества воды водных объектов рыбо- хозяйственного значения весной (в б. Камышовой, Круглой, Карантинной, Севастопольской) и летом (в б. Камышовой, Казачьей, Круглой, Стрелецкой), что указывает на повышение степени загрязненности взморья. Это же под- тверждают данные об окисляемости (превышение нормативов было отме- чено во всех бухтах и в разные сезоны) и о концентрации азота. Следует отметить, что на содержание биогенных веществ влияет динамика вод, ан- тропогенное загрязнение и взаимодействие с биотой.
На динамику численности, видовое разнообразие и продуктивность фи- топланктонного сообщества влияет комплекс различных факторов окружаю- щей среды: температура, свет, биогенные вещества, микроэлементы, поллю- танты, потребление другими компонентами пищевых цепей, динамика вод и т. д. Однако выделить влияние отдельных факторов в природных условиях не представляется возможным. Влияние температуры и света на размножение разных групп фитопланктона широко известно. Для исследования воздей- ствия микроэлементов и поллютантов необходимо проведение эксперимен- тальных работ. Для обсуждения влияния ветро-волновых процессов необхо- димы длинные ряды наблюдений. Материальной базой создания первичной продукции в водоемах являются биогенные вещества, представленные ми- неральными соединениями азота, фосфора и кремния. Концентрация этих веществ и их соотношение регулируют жизнедеятельность фитопланктона и обеспечивают биологическую продуктивность водных экосистем в целом. В связи с этим мы попытались оценить связи биогенных веществ с развитием фитопланктонных сообществ в исследуемых акваториях в разные сезоны.
Сезонной закономерности в изменении концентрации нитратного и орга- нического азота не наблюдали, что подтверждает влияние антропогенного загрязнения как основного источника азота. При этом концентрация нитрат- ного азота, необходимого для фитопланктона, варьировала в широких преде- лах. Максимальные концентрации NH4+ отмечены в осенний период, когда в составе планктона доминировали крупноклеточные диатомовые водоросли. Известно, что фитопланктон потребляет NH4 в процессе фотосинтеза, при этом водоросли затрачивают меньше энергии по сравнению с ассимиляцией нит- ратов [12]. Поглощение восстановленных форм азота, к которым относится NH4+, связано с размером клеток фитопланктона. Мелкоклеточный фито- планктон преимущественно ассимилирует аммонийный азот, тогда как круп- ноклеточный фитопланктон является основным потребителем нитратов [13]. Средние значения концентраций минеральных и органических форм азота в бухтах Камышовой, Казачьей и Круглой превышали аналогичные показате- ли, отмеченные до 2005 г. [2].
В период массового развития фитопланктона с преимущественным до- минированием кокколитофорид (весна 2021 г.) отмечены максимальные кон- центрации фосфатов. В этот же период значение коэффициента Редфилда РRat (N/P) минимально (1–3), что может свидетельствовать об азотном лими- тировании продуцирования фитопланктона. Аналогичные данные о биоген- ных элементах в весенний период получены А. С. Микаэляном с соавторами [14]. Авторы отметили интересную для Черного моря особенность: фосфаты положительно влияют на массовое развитие кокколитофорид при азотном лимитировании первичной продукции. В летний и осенний периоды мы от- мечали в большинстве случаев недостаток фосфора. Значимость минерально- го фосфора как ведущего фактора химического лимитирования продукции фитопланктона наряду с длительностью светового дня и температурой воды на взморье Севастополя отмечается в работе [15].
Содержание кремния в 2020–2022 гг. отличалось большой изменчиво- стью: значения плавно уменьшались от максимальных, зафиксированных весной к пониженным летом и осенью вследствие потребления этого элемента фитопланктоном. Вполне вероятно, что силикаты не были лимитирующим фактором для роста фитопланктона весной, когда наряду с кокколитофори- дами доминировали диатомовые водоросли. Самое низкое содержание крем- ния отмечено летом, когда отношение кремния к азоту составило менее 0.5, в этот период диатомовые не были доминирующей группой фитопланктона. Отклонение же от классических соотношений Редфилда (Si/N) летом и осе- нью в отдельных бухтах свидетельствует о более высоком потреблении сили- катов фитопланктоном по сравнению с нитратами.
Избыток азота в сочетании с недостатком фосфора, а в некоторых случа- ях и кремния привел к формированию несбалансированной стехиометрии растворенных биогенных веществ. Этот дисбаланс выразился в отклонениях от классических коэффициентов Редфилда (N/Si/P), а также в широких вари- ациях этих соотношений. Обогащение биосферы азотом, концентрация кото- рого в океане значительно превышает содержание фосфора, вызывает беспо- койство, поскольку это может повлиять на прибрежные экосистемы [16].
Прямого влияния биогенных элементов и фитопланктона на динамику плотности меропланктона не обнаружено. Вероятно, влияние фитопланктона имеет отсроченный характер, к тому же нельзя исключать основного влияния температурного фактора на массовое размножение отдельных таксонов меро- планктона. В то же время, учитывая, что личинки донных беспозвоночных пи- таются фитопланктоном, можно предположить и обратное влияние. Так, в июле 2021 г. в б. Круглой на фоне низких значений численности фитопланктона зарегистрировано максимальное значение плотности меропланктона, что мо- жет быть связано с выеданием фитопланктона личинками. Плотность меро- планктона осенью 2020 и весной 2021 г. в б. Камышовой и Севастопольской была высокой вследствие увеличения количества личинок усоногих раков и двустворчатых моллюсков, что связано с сезонными циклами их размноже- ния, и не зависела от гидрохимических параметров. При этом большое коли- чество причальных стенок, молов и других гидротехнических сооружений в указанных бухтах привлекает личинок этих групп меропланктона как удоб- ный субстрат для оседания.
Заключение
В период исследований отмечено увеличение уровня загрязнения взмо- рья Севастополя по сравнению с периодом 2001–2005 гг. Максимальные зна- чения БПК5 во всех бухтах превышали нормативы качества воды водных объ- ектов рыбохозяйственного значения. По этому показателю бухты можно рас- положить от наиболее загрязненной нестойкими органическими веществами к менее загрязненной в следующем порядке: Камышовая, Казачья, Карантин- ная, Севастопольская, Круглая, Стрелецкая. Максимальные значения окисля- емости во всех бухтах также превышали нормативы качества. Концентрация нитратов на Севастопольском взморье повышалась от весны к лету и понижа- лась к осени. Средние значения концентрации минеральных и органических форм азота в б. Камышовой, Казачьей и Круглой превышали аналогичные показатели, отмеченные до 2005 г. Минимальная концентрация нитратов от- мечена в б. Круглой, максимальная – в б. Карантинной. Концентрации аммо- нийного азота изменялись по сезонам аналогично изменчивости нитратов.
Состав сообщества фитопланктона показал значительную пространственно- временну́ ю изменчивость численности основных групп. Осенью доминиро- вали крупноклеточные диатомовые водоросли, в весенний период – мелко- клеточные колониальные диатомовые и кокколитофорида Emiliania huxleyi,летом по численности преобладали диатомовые, по биомассе – динофлагел- ляты. Отмечена относительная синхронность сезонной динамики плотности меропланктона в бухтах Севастополя – минимальные значения зарегистриро- ваны в холодный период года, а максимальные – в теплый. В меропланктоне доминировали по плотности науплиусы усоногого рака Amphibalanus improvisus, преобладающего в обрастании твердых субстратов. Максимальное количе- ство личинок этого вида зарегистрировано в б. Севастопольской и Камышовой. Полученные нами результаты могут быть использованы при оценке функциональной реакции прибрежных экосистем Черного моря на изменчивость антропогенных и природных факторов.
1. Павлова Е. В., Лисицкая Е. В. Состояние зоопланктонных сообществ в прибрежных водах Карадагского природного заповедника в 2002–2005 гг. // Карадаг – 2009 : сборник научных трудов, посвященный 95-летию Карадагской научной станции и 30-летию Карадагского природного заповедника Национальной академии наук Украины / ред. А. В. Гаевская, А. Л. Морозова. Севастополь : ЭКОСИ-Гидрофи- зика, 2009. C. 292–312. EDN ZTSFYD.
2. Гидрохимическая характеристика отдельных бухт Севастопольского взморья / Е. А. Куфтаркова [и др.] // Труды Южного научно-исследовательского инсти- тута морского рыбного хозяйства и океанологии. Керчь : ЮгНИРО, 2008. Т. 46. С. 110–117. EDN VSMAKD.
3. Комплексные исследования экологического состояния прибрежной акватории Севастополя (Западный Крым, Черное море) / В. И. Рябушко [и др.] // Экологическая безопасность прибрежной и шельфовой зон моря. 2020. № 1. С. 103–118. EDN HETKTQ. https://doi.org/10.22449/2413-5577-2020-1-103-118
4. Manilyuk Y. V., Lazorenko D. I., Fomin V. V. Seiche oscillations in the system of Sevastopol Bays // Water Resources. 2021. Vol. 48, iss. 5. P. 726–736. EDN JYJFLJ. https://doi.org/10.1134/S0097807821050122
5. Ломакин П. Д., Чепыженко А. А. Гидрофизические условия и характеристика загряз- нения вод бухты Казачья (Крым) в сентябре 2018 года // Системы контроля окру- жающей среды. 2019. № 1. С. 48–54. EDN ZDRMSD. https://doi.org/10.33075/2220- 5861-2019-1-48-54
6. Ломакин П. Д., Чепыженко А. И. Оценка загрязнения вод Стрелецкой бухты (Крым), связанного с эксплуатацией флота // Эксплуатация морского транспорта. 2019. № 3. С. 131–136. EDN HKMAEY. https://doi.org/10.34046/aumsuomt92/20
7. Источники загрязнения прибрежных вод Севастопольского района / В. М. Гру- зинов [и др.] // Океанология. 2019. Т. 59, № 4. С. 579–590. EDN VEOVBB. https://doi.org/10.31857/S0030-1574594579-590
8. Лях А. М., Брянцева Ю. В. Компьютерная программа для расчета основных пара- метров фитопланктона // Экология моря. 2001. Вып. 58. C. 87–90. EDN WIAGOT.
9. Long-term variations of thermohaline and hydrochemical characteristics in the mussel farm area in the coastal waters off Sevastopol (Black Sea) in 2001–2018 / S. V. Kap- ranov [et al.] // Continental Shelf Research. 2020. Vol. 206. P. 104–185. EDN SISXSM. https://doi.org/10.1016/j.csr.2020.104185
10. Подымов О. И., Зацепин А. Г., Очередник В. В. Рост солености и температуры в деятельном слое северо-восточной части Черного моря с 2010 по 2020 год // Морской гидрофизический журнал. 2021. Т. 37, № 3. С. 279–287. EDN GVAYYQ. https://doi.org/10.22449/0233-7584-2021-3-279-287
11. Ломакин П. Д. Чепыженко А. И., Попов М. А. Антропогенные изменения морфо- метрических характеристик бухты Круглой (Крым) // Биоразнообразие и устой- чивое развитие. 2024. Т. 9, № 1. С. 77–90. EDN PJWLZF.
12. Dortch Q. The interaction between ammonium and nitrate uptake in phytoplankton // Marine Ecology Progress Series. 1990. Vol. 61. P. 183–201. https://doi.org/10.3354/meps061183
13. The contribution of small phytoplankton communities to the total dissolved inorganic nitrogen assimilation rates in the East/Japan Sea: An experimental evaluation / P. S. Bhavya [et al.] // Journal of Marine Science and Engineering. 2020. Vol. 8, iss. 11. 854. https://doi.org/10.3390/jmse8110854
14. Микаэлян А. С., Силкин В. А., Паутова Л. А. Развитие кокколитофорид в Черном море: межгодовые и многолетние изменения // Океанология. 2011. Т. 51, № 1. С. 45–53. EDN NDJCPH.
15. Влияние первичной продукции фитопланктона на оборот биогенных элементов в прибрежной акватории Севастополя (Черное море) / В. Н. Егоров [и др.] // Биоло- гия моря. 2018. Т. 44, № 3. С. 207–214. EDN XPTTZB.
16. Sutcu A., Kocum E. Phytoplankton stoichiometry reflects the variation in nutrient con- centrations and ratios in a nitrogen-enriched coastal lagoon // Chemistry and Ecology. 2017. Vol. 33, iss. 5. P. 464–484. https://doi.org/10.1080/02757540.2017.1316492