Russian Federation
Sevastopol, Russian Federation
Russian Federation
UDC 574.24
UDC 528.88
UDC 262.5
Purpose. Monitoring of coccolithophore “blooms” is becoming increasingly important due to their influence on the biogeochemical cycles. The purpose of the study is to analyze the frequency, intensity and area of Gephyrocapsa huxleyi “bloom” in different sub-regions of the Black Sea, as well as to assess the affect of environmental factors on the intensity and interannual variability of “bloom”. Methods and Results. Based on the satellite data and using the regional algorithms, the values of chlorophyll a concentration, the particulate backscattering coefficient and the coefficient of light absorption by colored detrital matter were retrieved with a two-week averaging for different Black Sea sub-regions for the period 1998–2023. Application of the normalized anomalies made it possible to reveal the annual cycles of variability of these parameters, as well as to identify their common patterns and variability features in particular sub-regions of the sea. Conclusions. It has been revealed that in early June in all the regions of the sea, the “bloom” of Gephyrocapsa huxleyi was regularly observed; at that it was characterized by a year-to-year variability in its intensity and area. High light intensity in the sea upper mixed layer is a key factor for a shift in the phytoplankton species structure and for the transition to Gephyrocapsa huxleyi dominance and “bloom” due to the physiologically determined capacity for of these algae to grow at an extremely high light intensity with no inhibition, whereas at similar light conditions the growth of other plankton microalgae is suppressed. In most sub-regions of the Black Sea, the “bloom” of Gephyrocapsa huxleyi is not fol- lowed by an increase in the phytoplankton biomass, only species structure of phytoplankton changes. The exception is the coastal waters affected by the river runoffs: the “bloom” there is observed when the phytoplankton biomass increases. In the coastal waters during a cold period (December, February), the Gephyrocapsa huxleyi abundance sometimes increases due to a decrease of nutrient supply that results from weakening of the river runoffs and/or increasing stability of the water column. Decrease in phytoplankton supply with nutrients contributes to the competitive growth of coccolithophores as compared to other types of phytoplankton. The development of Gephyrocapsa huxleyi “bloom” in different seasons can reflect its genetic and physiological plasticity.
coccolithophores, Gephyrocapsa huxleyi, Emiliania huxleyi, coccolithophore “bloom”, wa-ter bloom, chlorophyll concentration, light scattering, light absorption, colored detrital matter, remote sensing, Black Sea
Введение
Кокколитофориды (Coccolothophyceae) – это планктонные гаптофитовые водоросли, повсеместно распространенные в Мировом океане [1], отличитель-ным признаком которых являются покрывающие всю поверхность клетки из-вестковые (CaCO3) пластинки – кокколиты. Наиболее изученным видом этой группы является Gephyrocapsa huxleyi (Lohmann) P.Reinhardt, 1972 syn. Emili-ania huxleyi (Lohmann) W.W.Hay & H.Mohler 1967 1. Массовое развитие этого вида периодически фиксируется в разных районах океана и приводит к мощ-ному цветению моря, покрывающему площади в сотни тысяч квадратных ки-лометров [1, 2].
Кокколитофориды являются важными продуцентами органического веще-ства в океане, их долю в первичной продукции оценивают в 1–10 %, они также играют ключевую роль в образовании CaCO3 и формировании известковых донных отложений [3, 4]. C накоплением коккосфер и отдельных кокколитов в воде существенно изменяются оптические характеристики моря [2, 3]. Про-гнозируется, что текущие климатические изменения могут существенно по-влиять на рост кокколитофорид и процессы кальцификации, причем разнона-правленно в низких и высоких широтах [5, 6]. За последние два десятилетия отмечено значительное увеличение численности кокколитофорид в Атланти-ческом океане [7, 8]. В связи с существенным влиянием этих микроводорослей на глобальный круговорот углерода [5, 6, 9] исследование «цветения» G. hux-leyi становится еще актуальнее [2].
В наиболее общем виде «цветение» можно определить как накопление биомассы фитопланктона в пределах определенной акватории в результате превышения скорости роста микроводорослей над темпами потерь клеток. По-тери клеток связаны с их естественной смертностью и выеданием зоопланкто-ном. За увеличением биомассы следует период снижения ее значений до зна-чений, близких к базовым [10]. Чаще всего наблюдается вспышка численности одного (моновидовое «цветение») или 2–3 видов микроводорослей, которая сопровождается повышением биомассы фитопланктона и продолжается в ос-новном от недели до месяца [11, 12]. Высокая степень доминирования отдель-ного таксона является важным признаком «цветения» и определяется способ-ностью определенных видов нарастать быстрее в данных условиях среды по сравнению с другими видами водорослей [11, 13, 14].
Весеннее «цветение» фитопланктона, которое регулярно наблюдают в средних и высоких широтах, связано с быстрым ростом диатомовых водо-рослей на фоне благоприятных световых условий, высокой доступности пита-тельных солей и слабого пресса выедания, характерного для этого сезона [15–17]. Благодаря физиологическим особенностям диатомовых водорослей, ско-рость их роста достигает максимума в условиях интенсивного вертикального перемешивания вод при высоких концентрациях биогенных элементов в среде [13, 18]. Накопление биомассы водорослей происходит до тех пор, пока чис-ленность питающегося ими зоопланктона не увеличится в ответ на увеличение пищи и/или не истощится запас питательных веществ [19]. Идентификация «цветения» и анализ его динамики проводится по биомассе фитопланктона, ко-торую зачастую регистрируют с использованием концентрации основного фо-тосинтетически активного пигмента – хлорофилла а – в качестве маркера [11].
В отличие от весеннего «цветения» диатомовых, массовое развитие кок-колитофорид чаще всего не сопровождается существенным приростом био-массы фитопланктона [20, 21], поэтому в качестве критерия для идентифика-ции «цветения» кокколитофориды G. huxleyi используется ее численность, за пороговое значение которой принимается 1 млн клеток в литре. Обычно «цве-тение» G. Huxleyi 1 наблюдается на фоне высокой солнечной инсоляции и огра-ниченной биогенной обеспеченности [1–3].
Исследования, которые проводились в Черном море на регулярной основе в течение двух лет, показали изменение видовой структуры фитопланктона в конце весны – начале лета при постоянной концентрации хлорофилла а [20]. Основу фитопланктона в мае составляли динофлагелляты, а в июне в сообще-стве доминировали кокколитофориды, вклад которых в биомассу фитопланк-тона достигал 80 % [20]. Высокая численность G. huxleyi, более миллиона кле-ток в литре, была зафиксирована в прибрежных и шельфовых водах и в холод-ный период года [22].
Дистанционные методы открывают широкие возможности для исследова-ний качества и продуктивности вод на разных временных и пространственных масштабах. Дистанционная диагностика «цветения» кокколитофорид осно-вана на уникальных оптических характеристиках их клеток – на порядок более высоком, по сравнению с другими микроводорослями, показателем рассеяния света назад (bbp), связанным с высоким показателем преломления света кокко-литами и коккосферой [23]. На основе спутниковых данных было показано, что в Черном море «цветение» кокколитофорид наблюдается ежегодно в нача-ле лета [24–28]. Однако внутригодовая динамика концентрации G. huxleyi в разных районах Черного моря, связь с концентрацией хлорофилла а – марке-ром биомассы фитопланктона, влияние условий среды на динамику этих пока-зателей исследованы недостаточно.
Созданные для Черного моря региональные спутниковые алгоритмы: 1)восстановления первичных гидрооптических характеристик поверхност-ного слоя вод [29], в том числе и bbp; 2) оценки концентрации хлорофилла а (Ca) [30] – позволяют анализировать сезонную и межгодовую динамику этих параметров в различных районах моря, их связь с условиями среды, такими как температура поверхности моря (SST), глубина верхнего квазиоднородного слоя (ZUML) и фотосинтетически активная радиация, падающая на поверхность моря (PAR0).
Целью настоящего исследования является анализ частоты, интенсивности и площади «цветения» G. huxleyi в различных районах Черного моря, а также оценка влияния условий среды на интенсивность «цветения» и его межгодо-вую изменчивость.
Методы
Оценка показателя bbp на длине волны 555 нм (bbp(555)) выполнена на ос-нове спутниковых данных с использованием региональной модели [29]. Кон-центрацию клеток G. huxleyi (NEh) определяли по зависимости NEh от bbp(555), установленной на основе in situ данных о NEh [31].
Значения Ca и показателя поглощения света окрашенным неживым веще-ством на длине волны 490 нм (aCDM(490)) определяли на основе спутниковых данных с использованием регионального алгоритма [30]. Значения ZUML были определены в соответствии с [32].
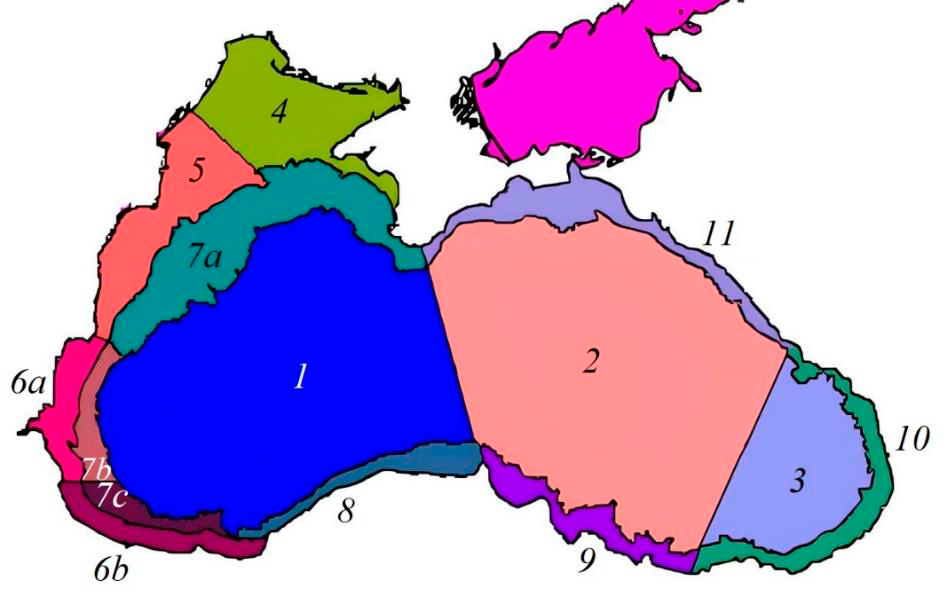
Р и с. 1. Районирование Черного моря по гидродинамическим характеристикам [33]
F i g. 1. Map of the Black Sea sub-regions defined by hydrodynamic features [33]
Для районов Черного моря (рис. 1), выделенных в соответствии с гидро-физическими особенностями [33], рассчитывали средние по району значения исследуемых параметров с двухнедельным осреднением за период 1998–2023 гг. Из анализа была исключена 2-километровая полоса вод вдоль всего черноморского побережья. Для оценки сезонной динамики bbp(555), NEh, SST, Ca, aCDM(490) и ZUML использовали среднемесячную аномалию изменений па-раметра, нормализованную на стандартное отклонение (𝑋𝑖𝑗σ), которую рассчи-тывали по уравнению
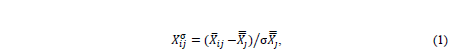
где X – рассматриваемый параметр; 𝑋̅𝑖𝑗–его среднемесячное значение для ме-сяца i и для района j; 𝑋𝑗̿ и σ𝑋𝑗̿ – среднемноголетнее значение и стандартное отклонение (SD) параметра для района j. Межгодовую изменчивость параметра X оценивали с использованием аномалии его изменения, нормализованную на SD (𝑋𝑖𝑗𝑦σ), которую рассчитывали следующим образом:

где 𝑋̅𝑖𝑗𝑦–среднемесячное значение для месяца i, года y и района j;𝑋̿𝑖𝑗 и σ𝑋̿𝑖𝑗 – среднемноголетнее значение и SD для месяца i, района j.
Освещенность в пределах верхнего квазиоднородного слоя определяли по PAR0 (данные спектрорадиометров SeaWiFS и MODIS) с использованием соот-ношения между глубиной зоны фотосинтеза (Z1%) и ZUML. Значения Z1% оцени-вали по показателю диффузного ослабления света на длине волны 490 нм, вос-становленному на основе спутниковых данных (SeaWiFS и MODIS) в соответ-ствии с [34].
Результаты
Были получены ряды данных (bbp(555), NEh, SST, Ca, aCDM(490), ZUML), рас-считанные с двухнедельным осреднением для каждого района моря (рис. 1) с 1998 по 2023 г. На рис. 2 представлена динамика bbp(555) в каждом районе моря за исследованный период. Во всех районах моря очевидна сезонная и межгодовая изменчивость этого параметра (рис. 2).
Нормализованные аномалии изменения всех параметров позволили вы-явить их внутригодовую цикличность (рис. 3). Максимум bbp(555) в июне наблюдается с высокой вероятностью (нормированная аномалия более 2) по-чти во всех районах моря. На северо-западном шельфе (район 4) максимум bbp(555) отмечается в разные месяцы на протяжении лета, что снижает стати-стическую вероятность его проявления (нормированная аномалия около 1) (рис. 3). В Черном море годовая динамика Ca характеризуется минимумом в летнее время, за исключением прибрежных вод, подверженных влиянию стока рек Дунай, Днепр и Днестр (районы 4, 5 и 6а), где летом прослеживается увеличение Ca (рис. 3). Среднемноголетние значения параметров (𝑋𝑗̿) и SD (σ𝑋𝑗̿) (таблица) сов-местно с годовой динамикой нормированных аномалий (см. рис. 2) позволяют рассчитать средние значения трех параметров для каждого месяца в отдельном районе моря, используя уравнение (1). В глубоководных районах моря (районы 1–3) среднемноголетнее значение Ca составляло в июне 0,15–0,25 мгм−3.
Сравнение годовых циклов изменчивости bbp(555) и Ca не выявило связи между этими параметрами (рис. 3). Регулярно наблюдаемый в июне максимум bbp(555) не сопровождается повышением значений Ca во всех районах моря, за исключением прибрежных вод, подверженных стоку рек Дунай, Днепр и Днестр (районы 4, 5, 6а), в которых летний максимум bbp(555) наблюдается на фоне весенне-летнего повышения Ca (рис. 3)
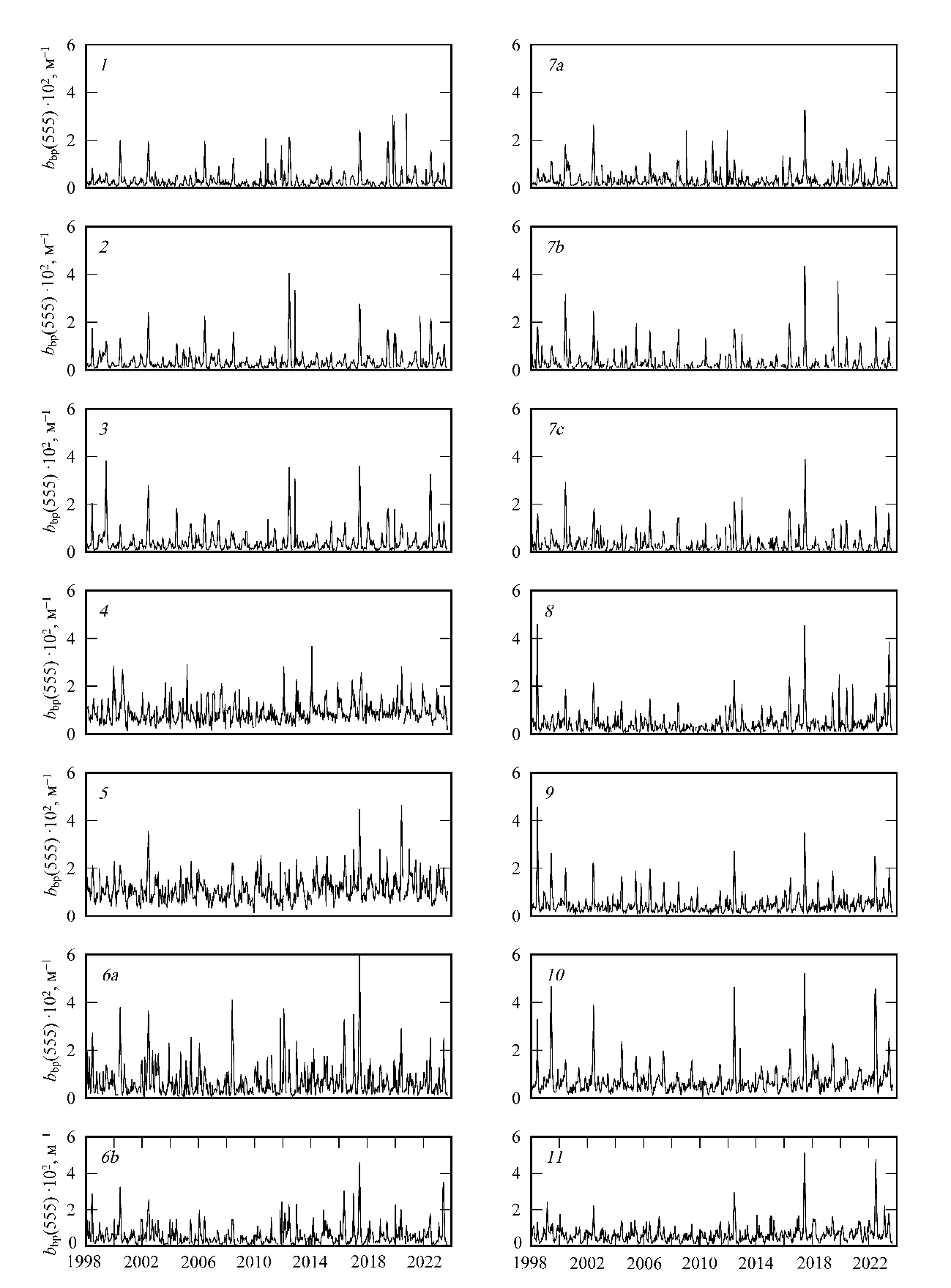
Р и с. 2. Динамика двухнедельных значений показателя рассеяния света назад частицами в море на длине волны 555 нм (bbp(555)102), рассчитанных для всех районов Черного моря (в этом и следующих рисунках номер района обозначен в левом верхнем углу каждого фрагмента)
F i g. 2. Dynamics of two-week averages of particulate back scattering coefficient at wavelength 555 nm (bbp(555)102) calculated for all the regions of the Black Sea (in this and the following figures, the region number is in the upper left corner of each fragment)
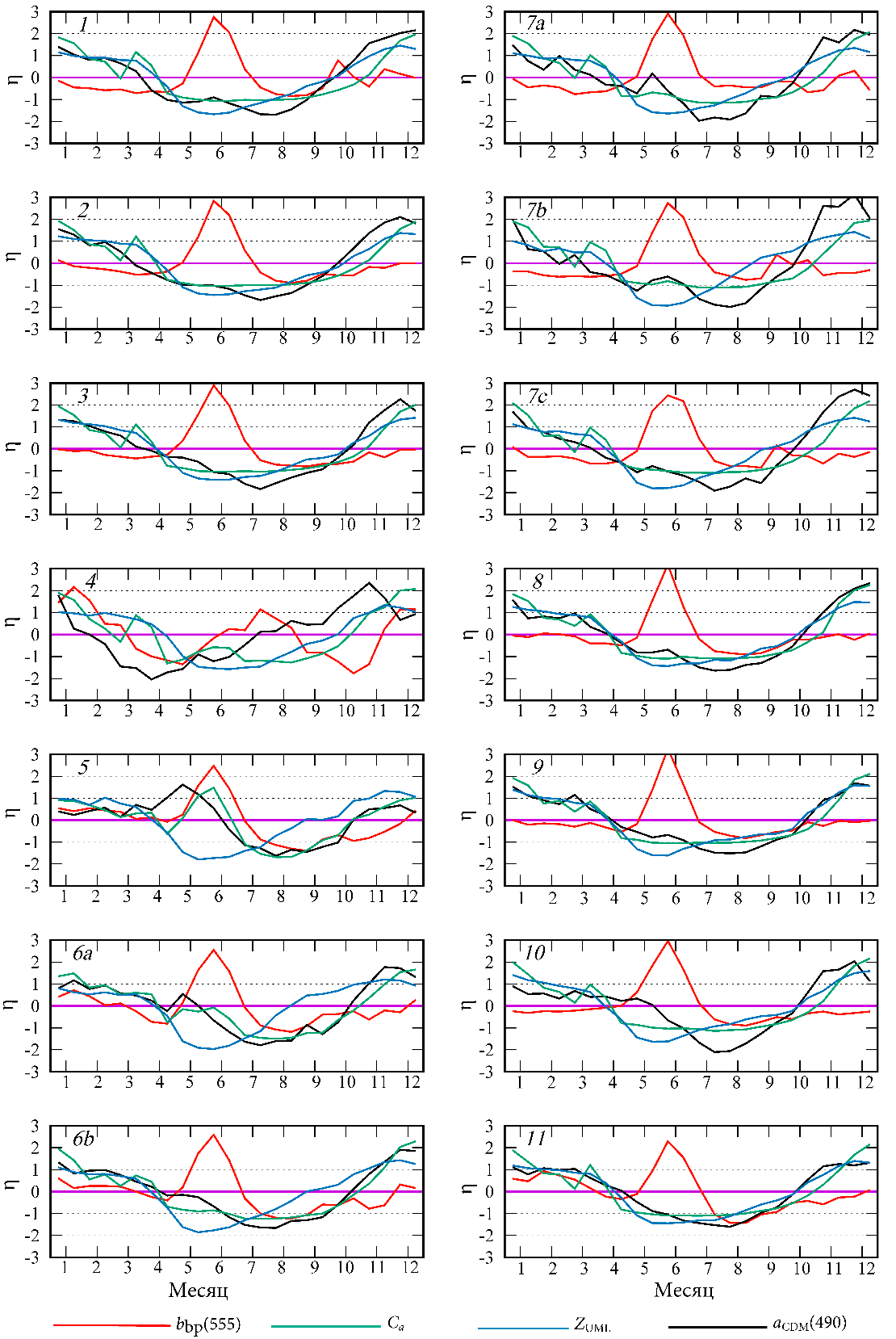
Р и с. 3. Нормализованные аномалии η показателя рассеяния света назад частицами в море на длине волны 555 нм (bbp(555)), концентрации хлорофилла а (Ca), толщины верхнего квазиодно-родного слоя моря (ZUML), показателя поглощения света окрашенным растворенным органиче-ским веществом в сумме с неживым взвешенным веществом на длине волны 490 нм (𝑎CDM(490)) в отдельных районах Черного моря
F i g. 3. Normalized anomalies η of the particulate backscattering coefficient at wavelength 555 nm (bbp(555)), concentration of chlorophyll a (Ca), thickness of the upper mixed layer (ZUML), coefficient of light absorption by colored detrital matter in total with non-algal particles at wavelength 490 nm (𝑎CDM(490)) in particular regions of the Black Sea
Среднемноголетние значения концентрации хлорофилла а (Ca), мгм−3, показателя поглощения света окрашенным растворенным органическим веществом в сумме с неживым взвешенным веществом на длине волны 490 нм (𝒂𝐂𝐃𝐌(𝟒𝟗𝟎)), м−1, концентрации клеток G. huxleyi (NEh), млн кл. л−1, рассчитанные для поверхностного слоя в разных районах Черного моря
Long-term average values of chlorophyll a concentration (Ca), mgm-3, light absorption coefficient by colored detrital matter in total with non-algal particles at wavelength 490 nm (𝒂𝑪𝑫𝑴(𝟒𝟗𝟎)), m−1, and concentration of G. huxleyi cells (NEh), mln celll-1 calculated for the water upper layer in different regions of the Black Sea
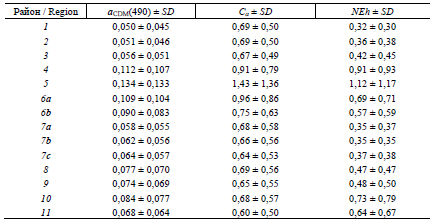
П р и м е ч а н и е: SD – среднее квадратическое отклонение.
N o t e: SD is standard deviation
В этих районах (4, 5 и 6а) значения bbp(555) изменяются обратно пропор-ционально значениям Ca (рис. 4).
На северо-западном шельфе (район 4) прослеживается локальное повыше-ние Ca и 𝑎CDM(490) в мае – июне (см. рис. 3). Вблизи устья Дуная (район 5) увеличение Ca и 𝑎CDM(490) в мае – июне выражено в большей степени и нор-мализованные значения аномалий этих параметров превышают 1 (см. рис. 3).
Максимум bbp(555), регулярно наблюдаемый во всех районах моря в нача-ле лета, связан с «цветением» G. huxleyi, что подтверждается данными натур-ных наблюдений. Концентрацию клеток G. huxleyi (N, млн кл. л−1) можно оце-нить достаточно точно на основании параметров зависимости между значени-ями bbp(555), м−1, рассчитанными по спутниковым данным, и численностью клеток кокколитофорид, определенной непосредственно в пробах морской воды [31]:
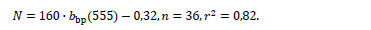
Анализ межгодовой динамики NEh и ZUML, рассчитанной на основе норма-лизованных значений аномалий, показывает, что экстремумы двух кривых в большинстве случаев находятся в противофазе (рис. 5). Сравнение средних для июня значений ZUML и NEh, полученных в разные годы, свидетельствует об обратной зависимости между этими параметрами, которая наиболее выра-жена при значениях NEh менее 1 (рис. 6)
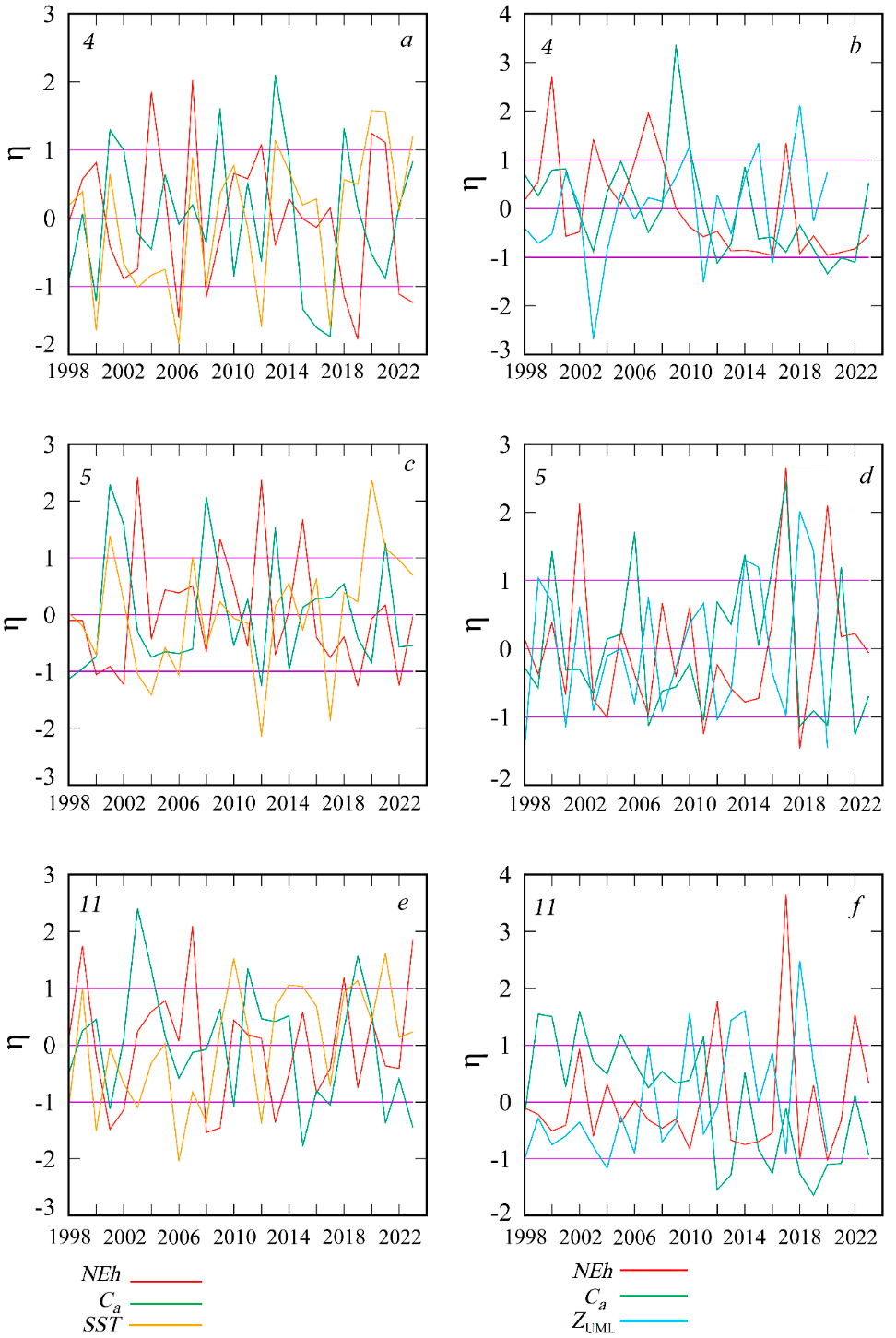
Р и с. 4. Межгодовая изменчивость η нормализованных аномалий численности G. huxleyi (NEh), кон-центрации хлорофилла а (Ca), температуры поверхностного слоя моря (SST) и толщины верхнего квази-однородного слоя моря (ZUML) в феврале (a, c, e), июне (d, f) и августе (b) в районах 4, 5 и 11
F i g. 4. Interannual variability η of normalized anomalies of G. huxleyi cell abundance (NEh), chloro-phyll a concentration (Ca), sea surface temperature (SST), and thickness of the upper mixed layer (ZUML) in February (a, c, e), June (d, f) and August (b) in regions 4, 5 and 11
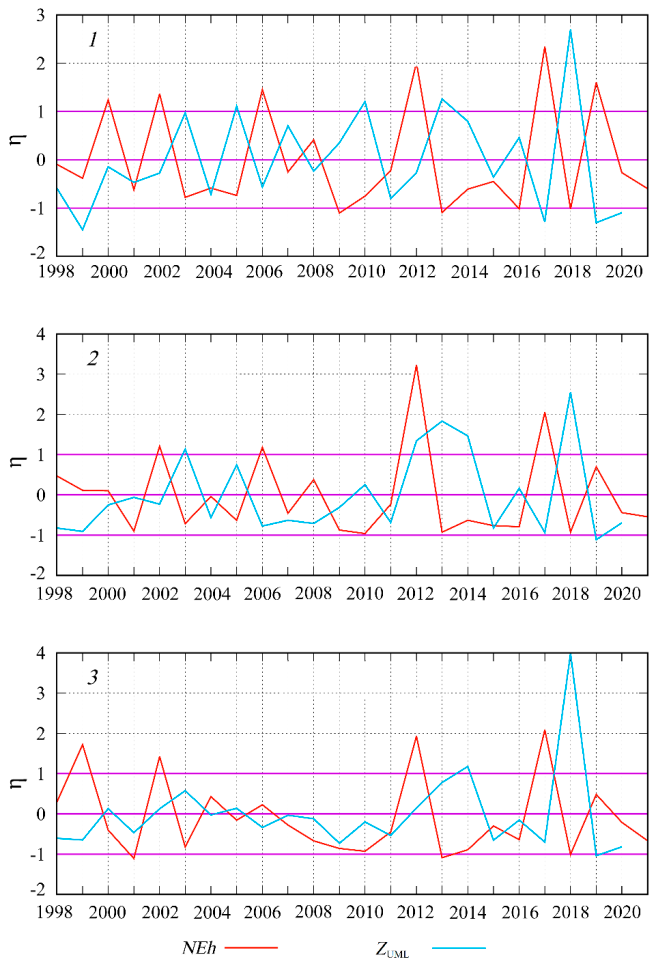
Р и с. 5. Межгодовая изменчивость η нормализованных аномалий численности клеток G. huxleyi (NEh) и толщины верхнего квазиоднородного слоя (ZUML) в июне в районах 1, 2 и 3 Черного моря
F i g. 5. Interannual variability η of normalized anomalies of G. huxleyi cell abundance (NEh) and thickness of the upper mixed layer (ZUML) in June in regions 1, 2 and 3 in the Black Sea
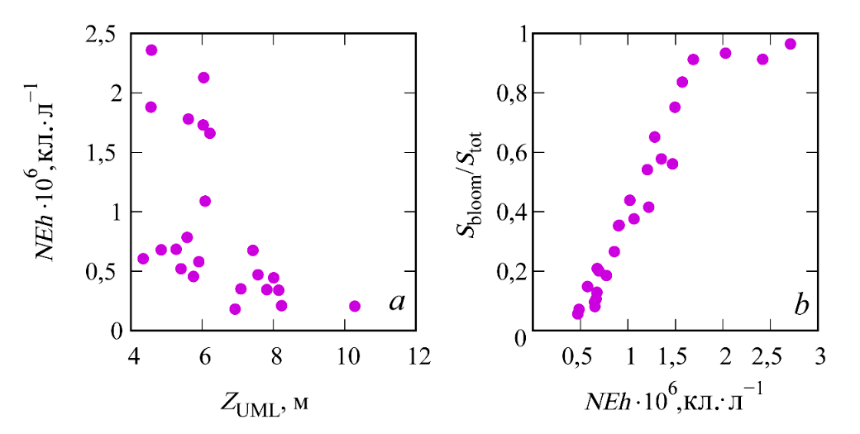
Р и с. 6. Зависимость между толщиной верхнего квазиоднородного слоя моря в июне (ZUML) и численностью клеток G. huxleyi (NEh) в западной глубоководной части моря (район 1) (a), между NEh в глубоководной части моря (район 1 и 2) и площадью «цветения» относительно площади моря (Sbloom/Stot) (b)
F i g. 6. Relationship between the upper mixed layer thickness (ZUML) in June and the G. huxleyi cell abundance (NEh) in the western deep-sea part (region 1) (a), and between (NEh) in the deep part of the sea (region 1 and 2) and “bloom” area relative to the total sea area (Sbloom/Stot) (b)
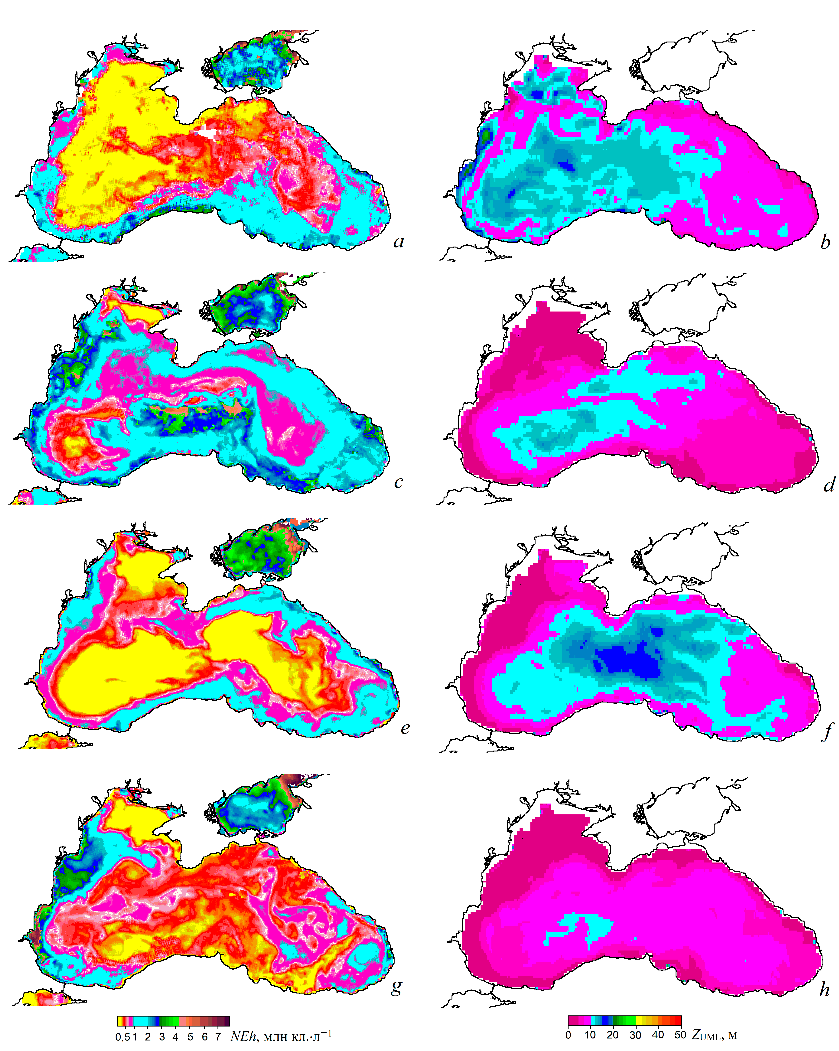
Р и с. 7. Карты численности G. huxleyi (NEh) (a, c, e, g) и глубины верхнего перемешанного слоя (ZUML) (b, d, f, h) в начале «цветения» во второй половине мая 1998 (a, b), 2002 (c, d), 2004 (e, f), 2008 гг. (g, h) (источник данных о ZUML – работа [32])
F i g. 7. Maps of G. huxleyi cell abundance (NEh) (a, c, e, g) and upper mixed layer thickness (ZUML) (b, d, f, h) at the onset of “bloom” in the second half of May, 1998 (a, b), 2002 (c, d), 2004 (e, f), 2008 (g, h) (data on ZUML are from [32])
ГИДРОФИЗИЧЕСКИЙ ЖУРНАЛ том 40 № 6 2024 865
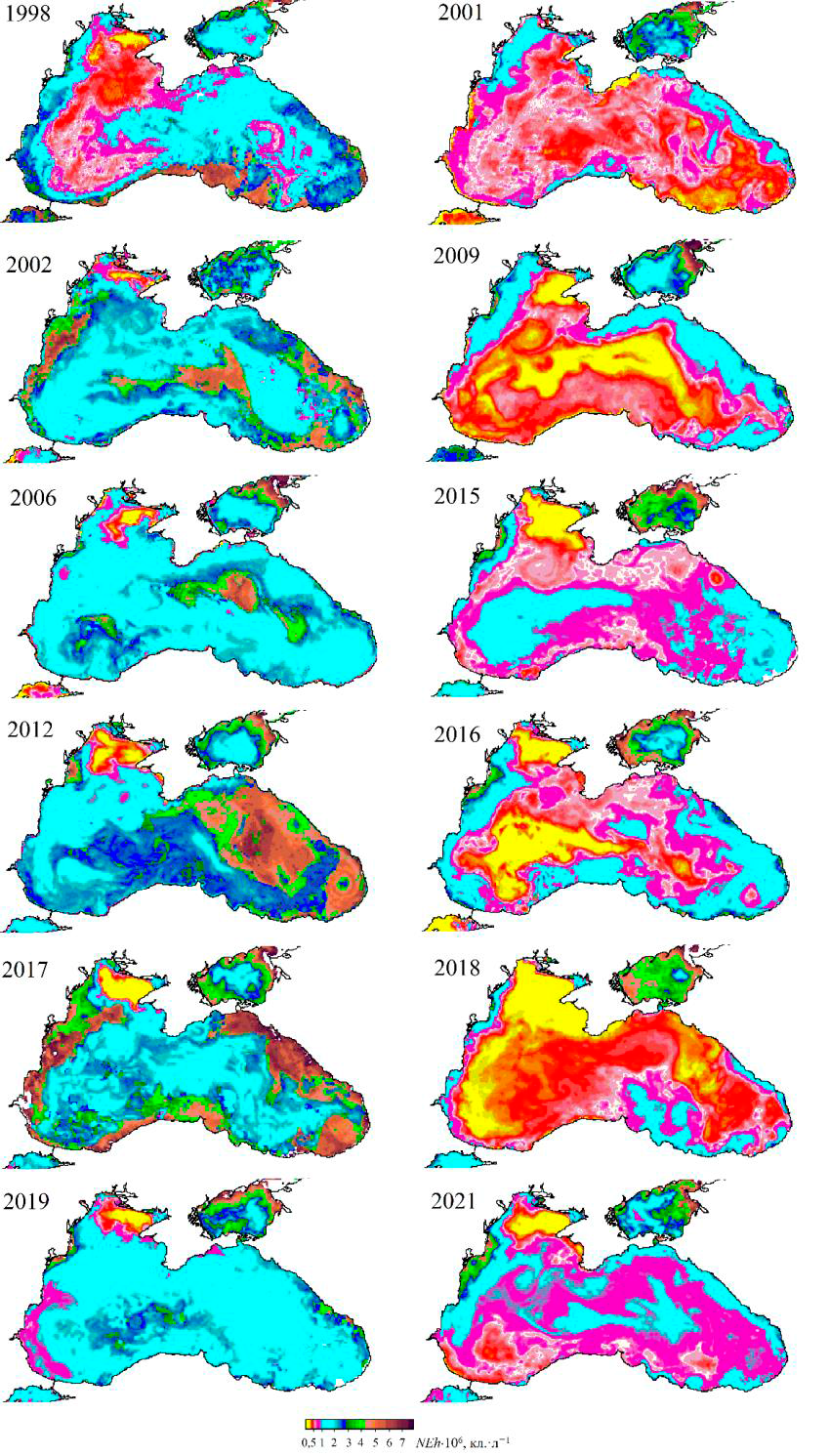
Р и с. 8. Карты пространственного распределения концентрации клеток G. huxleyi (NEh) в по-верхностном слое Черного моря в первой половине июня в 1998, 2002, 2005, 2006, 2012 и 2017 (слева), 2001, 2009, 2011, 2015, 2016, 2018, 2021 гг. (справа)
F i g. 8. Maps of spatial distribution of G. huxleyi cell concentration (NEh) in the Black Sea surface layer: in the first half of June in 1998, 2002, 2005, 2006, 2012, 2017 (left), 2001, 2009, 2011, 2015, 2016, 2018, 2021 (right)
На картах пространственного распределения NEh в конце мая, на который приходится начало «цветения», видно, что участки с более высокой численно-стью кокколитофорид совпадают с областями более тонкого верхнего квази-однородного слоя (рис. 7). Такая особенность пространственного распределе-ния NEh может свидетельствовать о влиянии ZUML на инициацию «цветения» G. huxleyi. В 1998, 2002, 2006, 2012, 2017 и 2019 гг. при относительно узком верхнем квазиоднородном слое в июне наблюдалось более интенсивное «цве-тение» G. huxleyi: значения NEh превышали 2 млн кл. л−1, достигая в отдель-ные годы 6 млн кл.л−1. И напротив, в 2001, 2009, 2015, 2016, 2018, 2021 гг. при относительно заглубленном верхнем квазиоднородном слое отмечалось менее интенсивное развитие кокколитофорид (NEh менее 1,2 млн кл.л−1) (рис. 8). Оценка межгодовой изменчивости площади «цветения» G. huxleyi с 1998 по 2022 г. показала, что самые большие площади, более 80 % поверхности моря, зафиксированы в 2002, 2006, 2012, 2017 и 2019 гг. (рис. 9). При этом площадь моря, занятая «цветением» в отдельные годы, была прямо пропорциональна средним значениям NEh в глубоководной части моря (см. рис. 6, b).
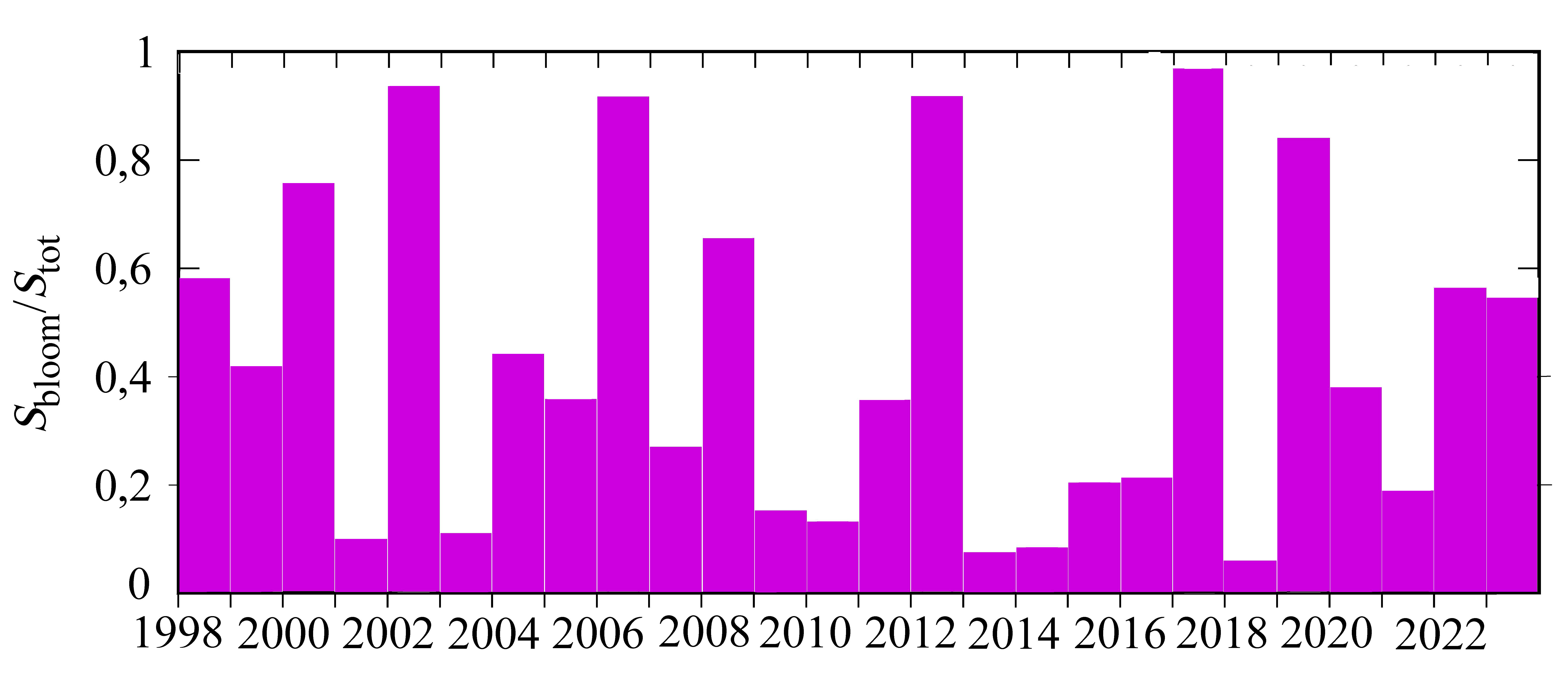
Р и с. 9. Межгодовая изменчивость площади (Sbloom/Stot) «цветения» G. huxleyi в июне
F i g. 9. Interannual variability of G. huxleyi “bloom” area (Sbloom/Stot) in June
На северо-западном шельфе (район 4), кроме максимума bbp(555) в начале лета, выраженное повышение bbp(555) отмечается в декабре и феврале, а у во-сточного побережья (район 11) повышенные значения аномалии годового хода (нормированная аномалия более 1) прослеживаются в феврале (см. рис. 3). В этих районах зимний и летний максимумы bbp(555) являются статистически значимыми, так как нормализованная аномалия равна 1 или более. В отличие от летнего максимума bbp(555), который отмечается на фоне годового мини-мума концентрации хлорофилла а, зимний максимум наблюдается в период высоких значений Ca.
Обсуждение
Анализ временных рядов нормализованных среднемесячных аномалий численности клеток G. huxleyi показал, что во всех районах Черного моря «цве-тение» регулярно происходит в начале июня (см. рис. 3). Во всем море, за исключением отдельных районов северо-западного шельфа (4, 5 и 6а), «цвете-ние» G. huxleyi наблюдается на фоне пониженных значений аномалий концен-трации хлорофилла а (см. рис. 3) и существенного сдвига в видовой структуре фитопланктона [20, 21]. Такие изменения обычно являются результатом резкого увеличения численности одного вида по сравнению с другими [11]. Прирост численности определяется превышением скорости роста водорослей над скоро-стью потерь клеток. Потери клеток связаны с их естественной смертностью и выеданием зоопланктоном [14, 16, 35, 36]. Поэтому увеличение доли G. huxleyi в структуре фитопланктона может быть результатом преимущественного (в сравнении с другими видами) роста и/или менее интенсивного их выедания.
Скорость роста планктонных водорослей регулируется комплексом фак-торов: освещенностью, температурой, обеспеченностью элементами мине-рального питания [37, 38]. При этом свет в наибольшей степени влияет на из-менение ростовых характеристик фитопланктона [39]. Стратегия адаптации микроводорослей к световым условиям состоит в поддержании постоянной скорости роста в широком диапазоне интенсивности света в среде [40]. Свето-вое насыщение скорости роста диатомовых и динофитовых водорослей насту-пает при освещенности 50–80 мкЭм−2с−1 [40]. Насыщение скорости роста G. huxleyi в ранних исследованиях отмечали при интенсивности света 100–200 мкЭм−2с−1 [41, 42]. В более поздних исследованиях [43] световое насыще-ние скорости роста наблюдали при 65 мкЭм−2с−1, что соответствует значе-ниям, характерным для динофитовых и диатомовых водорослей [40]. Постоян-ная скорость роста (так называемое плато световой кривой) наблюдается вплоть до ~ 800 мкЭм−2с−1. Свет более высокой интенсивности ингибирует рост микроводорослей разной таксономической принадлежности [44]. Но для G. huxleyi это «плато» распространяется вплоть до 1200 мкЭм−2с−1 [43, 45].
Ингибирование скорости роста клеток связано с деструкцией реакцион-ных центров фотосистем в клетках, а именно с повреждением D1-белка в ре-акционном центре фотосистемы II [46]. Детальное исследование структуры пигментного комплекса и функциональных характеристик G. huxleyi показало, что высокая интенсивность света не приводит к ингибированию роста благо-даря активной фотопротекторной функции пигментно-белкового комплекса. Фотопротекторы способствуют устойчивости к яркому свету благодаря мини-мизации накопления активных форм кислорода и предотвращения окислитель-ного повреждения [9], в результате чего повышается устойчивость реакцион-ных центров фотосистемы II к воздействию света высокой интенсивности [43]. Кроме этого, кокколиты, покрывающие клетку G. huxleyi, способствуют более эффективному рассеиванию света по сравнению с другими видами микрово-дорослей (bbp различается почти на порядок) [23], что дополнительно защи-щает фотосинтетический аппарат кокколитофорид [2].
Период июньского «цветения» G. huxleyi в Черном море характеризуется самой высокой в годовом цикле инсоляцией поверхности моря (50 ± 4,3 Эм−2сут−1) [47, 48]и самым тонким верхним квазиоднородным слоем (см. рис. 3), что связанос появлением ступенчатой структуры стратификации в процессе прогрева по-верхности моря [21, 33, 49]. Ступенчатую температурную стратификацию поверхностных вод отмечали в начале лета в период «цветения» G. huxleyi в раз-ных регионах Мирового океана [50–53], при этом освещенность в пределах верхнего квазиоднородного слоя была экстремально высокой в годовом цикле (около 1000 мкЭм−2с−1) [1, 21, 53–57].
В этих условиях особенности морфологии и устойчивость фотосинтетиче-ского аппарата кокколитофорид обеспечивают им преимущество в скорости роста по сравнению с другими планктонными водорослями. В результате чис-ленность кокколитофорид начинает расти, развивается «цветение», в пике ко-торого биомасса фитопланктона в Черном море может быть представлена в ос-новном (до ~ 80 %) одним видом – G. huxleyi [20, 21].
Максимальная скорость роста водорослей (область «плато» на световой кривой) снижается при ограничении их роста недостатком биогенных элементов [37, 58–60]. С формированием сезонной стратификации вод ограничиваются восходящие потоки биогенных элементов в поверхностные воды из нижележа-щих богатых минеральными солями слоев. Это может приводить к снижению уровня биогенной обеспеченности фитопланктона в поверхностных водах [5]. Многочисленные исследования показывают, что G. huxleyi способна более эф-фективно расти при низких концентрациях неорганических соединений азота и фосфора в среде по сравнению с другими таксонами микроводорослей. При этом конкурентные преимущества роста G. huxleyi в условиях дефицита ми-нерального фосфора в среде проявляются в большей степени, чем при недо-статке минерального азота [44, 61–63]. Это может давать дополнительные пре-имущества для развития G. huxleyi в Черном море в начале лета, когда в условиях формирования сезонной стратификации поверхностных вод на фоне истощения запасов минеральных солей в холодном промежуточном слое моря в результате зимней конвекции восходящий поток биогенных элементов в зону фотосинтеза резко сокращается [64]. В планктонном сообществе происходит перестройка с внешних на внутренние источники минерального питания [65], и на этом фоне может наблюдаться дисбаланс потоков их поступления и потребления в зоне фо-тосинтеза, в большей степени проявляющийся именно в отношении фосфора [66]. В результате G. huxleyi получает дополнительные преимущества для роста по сравнению с водорослями других таксономических групп.
Предполагается, что некоторые кокколитофориды могут вести миксо-трофный или фагоцитарный образ жизни, о чем говорит их присутствие за пре-делами зоны фотосинтеза [67]. Экспериментальные исследования на культу-рах водорослей показали, что миксотрофия обеспечивает выживание клеток кокколитофорид при значениях интенсивности света ниже компенсационной точки фотосинтеза (скорость фотосинтеза компенсируется скоростью дыха-ния) за счет использования органических соединений в качестве источников энергии и/или углерода [68]. При этом в поверхностном, хорошо освещенном слое моря кокколитофориды G. huxleyi, очевидно, являются типичными авто-трофами.
Кокколитофориды служат пищей как для микро-, так и для мезозоопланк-тона, а известковый панцирь слабо защищает их от выедания [69]. Однако уро-вень выедания фитопланктона при увеличении доли кокколитофорид в составе сообщества, скорее всего, снижается. Исследования в Черном море показали, что доля кокколитофорид в рационе копепод очень небольшая, но для фильтраторов Oikopleura dioica и гетеротрофной динофлагелляты Noctiluca scintillans G. hux-leyi может составлять даже основу питания [70]. Таким образом, при увеличении доли кокколитофорид в фитопланктоне степень его выедания мезозоопланктоном может уменьшаться, если в составе последнего доминирует рачковый планктон.
Как следствие, может наблюдаться прирост биомассы G. huxleyi, за кото-рым можно ожидать увеличение численности видов фильтраторов. В то же время в большинстве районов Черного моря в мае – июне наблюдается сниже-ние общей биомассы мезозоопланктона, которое происходит на фоне измене-ний в структуре сообщества. Холодолюбивые представители рачкового планк-тона, составлявшие основу сообщества в марте – апреле, начинают замещаться теплолюбивыми видами, интенсивный рост которых начинается в июне [71, 72]. Поэтому снижение пресса выедания кормовым зоопланктоном в начале лета может способствовать приросту биомассы фитопланктона в этот период.
Микрозоопланктон также может влиять на численность клеток G. huxleyi [73]. В ряде исследований указывается, что динофлагелляты являются более приоритетным объектом питания для простейших по сравнению с кокколито-форидами [74–76]. Поэтому можно допускать некоторое ослабление пресса выедания при доминировании G. huxleyi в составе фитопланктона и со стороны микрозооплактона. В совокупности все вышеперечисленные факторы могут обеспечивать регулярный всплеск численности G. huxleyi в раннелетний пе-риод в большинстве районов Черного моря.
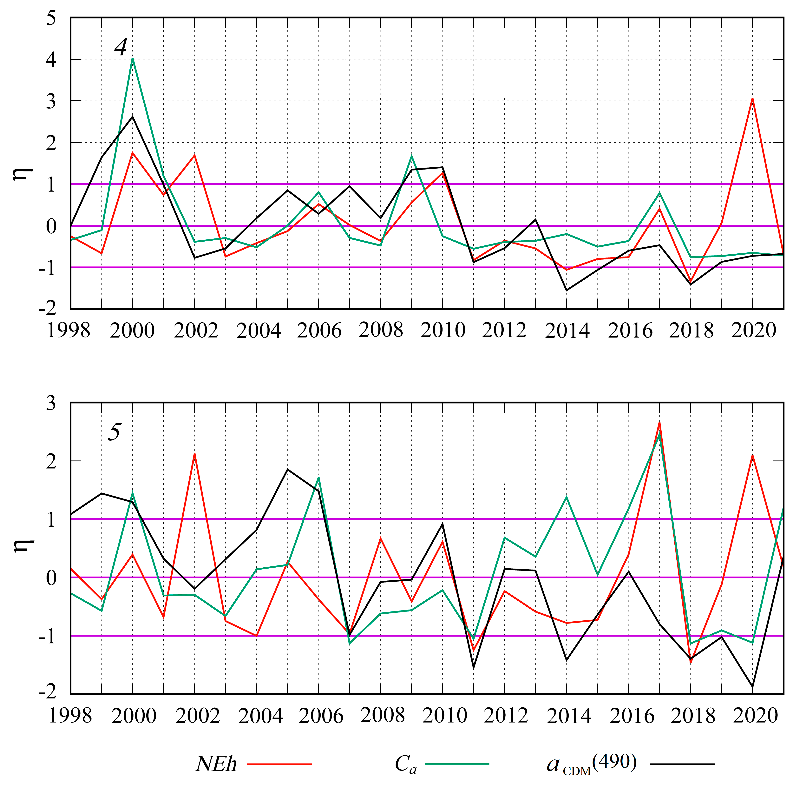
Р и с. 10. Межгодовая изменчивость нормализованных аномалий интенсивности «цветения» Gephyrocapsa huxleyi (NEh), концентрации хлорофилла а (Ca) и показателя поглощения света неживым взвешенным и растворенным органическим веществом (𝑎𝐶𝐷𝑀(490)) в июне в районах 4 и 5 Черного моря
F i g. 10. Interannual variability of normalized anomalies of G. huxleyi “bloom” intensity (NEh), chlo-rophyll a concentration (Ca) and light absorption index by non-algal suspended and dissolved organic matter (𝑎𝐶𝐷𝑀(490)) in June in regions 4 and 5 in the Black Sea
В прибрежных водах, подверженных влиянию стока рек Дунай, Днепр и Днестр (район 4, 5, 6а), летний максимум bbp(555) наблюдается на фоне увеличе-ния биомассы фитопланктона (см. рис. 3). Межгодовая изменчивость Ca как мар-кера биомассы фитопланктона в этих водах тесно связана с 𝑎CDM(490) (рис. 10).
Следует отметить, что величина 𝑎CDM(490) в приустьевых районах в ос-новном определяется количеством взвешенных и растворенных веществ, по-ступающих с речным стоком [77]. Кроме этого, речные воды несут большое количество различных минеральных соединений, необходимых для развития фитопланктона [78], поэтому вариабельность интенсивности речного стока в период половодья определяет межгодовую вариабельность Ca (биомассы фи-топланктона) в начале лета (рис. 10).
Наблюдаемое в это время увеличение bbp(555) связано преимущественно с повышением содержания кокколитофорид и кокколит, так как взвесь органи-ческой природы, включая и другие виды фитопланктона, характеризуется на порядок меньшими показателями bbp(555) [23]. Мы минимизировали влияние неживой взвеси на расчеты bbp(555) путем исключения из анализа 2-километ-ровой полосы прибрежных вод, где оседает основная часть минеральной взвеси, привносимая с речным стоком.
Следует отметить, что нормализованные аномалии bbp(555) для данных районов изменяются в разные годы в противофазе со значениями аномалий Ca и 𝑎CDM(490) (рис. 10). На основании такой динамики можно предполагать, что на фоне более низкого уровня речного стока и, соответственно, меньшего объ-ема поступления минеральных солей создаются благоприятные условия для конкурентного роста кокколитофорид, которые способны поддерживать высо-кие скорости роста при значительно меньшем содержании неорганического азота и фосфора в воде по сравнению с другими видами, особенно диатомо-выми водорослями [1, 13].
На мелководном северо-западном шельфе (район 4) значимо высокие ано-малии сезонного хода bbp(555) наблюдаются не только в июне, но и в зимние месяцы (см. рис. 3). Сопоставление межгодовой изменчивости февральских значений аномалий bbp(555) и Ca показало (см. рис. 4), что в большинстве слу-чаев экстремумы этих двух кривых находятся в противофазе. Это означает что вспышки развития кокколитофорид на северо-западном шельфе наблюдаются на фоне снижения общей биомассы фитопланктона в эти годы и, соответственно, угнетения роста типично зимнего комплекса видов фитопланктона, для которого характерно доминирование диатомей.
Регулярный мониторинг 1998–2000 гг. позволил сравнить внутригодовую динамику структуры сообщества фитопланктона в западной глубоководной части моря в годы с холодной и теплой зимой [20]. В холодную зиму 1998 г. фитопланктон был представлен комплексом диатомовых видов, и в начале марта наблюдали резкое увеличение биомассы фитопланктона на фоне интен-сивного «цветения» Proboscia alata.
В условиях относительно теплой зимы 1999 г. отмечалась большая чис-ленность кокколитофориды G. huxleyi, вклад которой в общую биомассу фи-топланктона в центре западной глубоководной части и в районе свала глубин достигал 40–70 % [20]. После теплой зимы не наблюдалось весеннего «цвете-ния» диатомовых водорослей [20]. Обилие G. huxleyi в фитопланктоне востолба, вследствие чего снижаются скорости восходящих потоков минераль-ных солей, которые в холодный период являются основным источником био-генных элементов для фитопланктона в зоне фотосинтеза [64, 65]. Соответ-ственно, при снижении уровня неорганического азота и фосфора в среде G. huxleyi получает преимущество и может достигать максимальных скоростей роста при значительно более низких концентрациях минеральных солей по сравнению с диатомовыми [1, 79–81]. В сочетании с благоприятными свето-выми условиями из-за слабого вертикального перемешивания вод это законо-мерно приводит к обильному развитию G. huxleyi в теплые зимы. Активное перемешивание вод в холодные зимы существенно ухудшает световые усло-вия в зоне фотосинтеза, однако интенсифицирует восходящие потоки биоген-ных элементов в зону фотосинтеза, что создает благоприятные условия для развития диатомовых водорослей, так как уровень светового насыщения роста у них существенно ниже, чем у кокколитофорид [3, 22, 82].
Развитие G. huxleyi в разные сезоны года отражает генетическую и физио-логическую пластичность G. Huxleyi [1]. Молекулярно-генетические исследо-вания показали, что в составе G. huxleyi выделяется, по крайней мере, две ге-нетические группы, различающиеся последовательностями митохондриаль-ного генома. Эти группы имеют разные температурные предпочтения: холод-новодная группа из субарктических вод Северной Атлантики и Тихого океана и тепловодная группа, встречающаяся в субтропических водах Атлантиче-ского и Тихого океанов, а также в Средиземном море [81]. Связь между от-дельными генетическими линиями G. huxleyi и физическо-химическими усло-виями в местах их обитания показана на основе обобщения данных из разных районов Мирового океана [83]. Внутривидовая генетическая изменчивость мо-жет прослеживаться не только между штаммами G. huxleyi из различных рай-онов, но и при исследованиях в границах отдельного «цветения». Эта измен-чивость связана с характеристиками ключевых физиологических процессов в клетках, включая скорости кальцификации, фотосинтеза, биохимической трансформации серы и липидов, ассимиляции азота и фосфора, которые в ко-нечном итоге влияют на функционирование всей экосистемы [84]. Поэтому це-левые генетические исследования черноморской популяции G. huxleyi стано-вятся важнейшей задачей для выявления закономерностей динамики «цвете-ния» этого вида или, возможно, комплекса видов.
Выводы
На основе спутниковых данных с использованием региональных алгорит-мов были восстановлены значения концентрации хлорофилла а, показателя рассеяния света назад взвешенным веществом и показателя поглощения света окрашенным растворенным органическим веществом в сумме с неживым взве-шенным веществом с двухнедельным осреднением для разных районов Чер-ного моря в период с 1998 по 2023 г.
На основе анализа изменчивости нормализованных аномалий этих пара-метров были установлены годовые циклы, выявлены общие закономерности и особенности их временной динамики в отдельных районах моря. Показано, что в начале июня во всех районах моря регулярно наблюдается массовое развитие кокколитофорид с межгодовыми различиями в интенсивности и площади их «цветения». «Цветение» G. huxleyi наблюдается ежегодно в начале лета во многих районах Мирового океана при как минимум одном общем условии – максимально высокой освещенности в пределах верхнего перемешанного слоя (около 1000 мкЭ⋅м−2⋅с−1). Этот фактор, очевидно, является ключевым для сдвига в структуре фитопланктонного сообщества и перехода к доминированию кокколитофорид (в частности, G. huxleyi) благодаря физиологически детерминированной возможности этих водорослей расти без угнетения при крайне высоких значениях интенсивности света, ингибирующей рост большинства других водорослей.
Показано, что в большинстве районов Черного моря «цветение» G. huxleyi в начале лета не сопровождается увеличением концентрации фотосинтетиче-ски активных пигментов в воде и, соответственно, биомассы фитопланктона, происходит замена видов водорослей на G. huxleyi. В прибрежных водах, под-верженных влиянию речного стока, интенсивное развитие G. huxleyi наблюда-ется на фоне повышения биомассы фитопланктона. Межгодовые колебания речного стока могут влиять на особенности весеннего развития фитопланктона в этих районах Черного моря. Более интенсивное развитие кокколитофорид наблюдается в годы, когда средние значения концентрации хлорофилла а уменьшаются. Массовое развитие кокколитофорид в Черном море может про-исходить и в холодный период года, но интенсивность и временная шкала та-ких процессов существенно меняются по акватории в разные годы, поэтому значимых пиков на кривой сезонного хода нормализованных аномалий рассе-яния света назад частицами взвеси в большинстве районов не наблюдается. Только на северо-западном шельфе происходит значимое и достаточно регу-лярное увеличение этого показателя в холодный период года (с декабря по фев-раль), при этом интенсивное развитие G. huxleyi отмечается на фоне снижения общей биомассы фитопланктона.
Таким образом, основным фактором, обеспечивающим преимущество G. huxleyi в развитии на протяжении всего года в Черном море, очевидно, яв-ляется способность кокколитофорид поддерживать высокие скорости роста при низких концентрациях биогенных элементов в воде. Поэтому доля G. hux-leyi в фитопланктоне в различных районах моря периодически возрастает при ухудшении условий минерального питания, в частности при снижении пото-ков биогенных элементов в результате повышения стабильности водного столба и/или уменьшения уровня берегового стока. Но в начале лета ключевым фактором, определяющим регулярное массовое развитие G. huxleyi по всей ак-ватории Черного моря, как и в других районах Мирового океана, является спо-собность кокколитофорид расти с максимальной скоростью в широком диапа-зоне значений освещенности, вплоть до экстремально высокой освещенности, ингибирующей рост всех остальных групп микроводорослей.
1. Representing key phytoplankton functional groups in ocean carbon cycle models: Coccolitho-phorids / M. D. Iglesias-Rodrıguez [et al.] // Global Biogeochemical Cycles. 2002. Vol. 16,iss. 4. 1100. https://doi.org/10.1029/2001GB001454
2. Balch W. M. The Ecology, Biogeochemistry, and Optical Properties of Coccolithophores // An-nual Review of Marine Science. 2018. Vol. 3, iss. 10. P. 71–98. https://doi.org/10.1146/an-nurev-marine-121916-063319
3. Balch W. M., Holligan P. M., Kilpatrick K. A. Calcification, photosynthesis and growth of thebloom-forming coccolithophore, Emiliania huxleyi // Continental Shelf Research. 1992.Vol. 12, is s. 12. P. 1353–1374. https://doi.org/10.1016/0278-4343(92)90059-s
4. Relating coccolithophore calcification rates to phytoplankton community dynamics: regionaldifferences and implications for carbon export / A. J. Poulton [et al.] // Deep Sea Research PartII: Topical Studies in Oceanography. 2007. Vol. 54, iss. 5–7. P. 538–557.https://doi.org/10.1016/j.dsr2.2006.12.003
5. Coccolithophore growth and calcification in a changing ocean / K. M. Krumhardt [et al.] //Progress in Oceanography. 2017. Vol. 159, iss. 23. P. 276–295.https://doi.org/10.1016/j.pocean.2017.10.007
6. Coccolithophore Growth and Calcification in an Acidified Ocean: Insights from CommunityEarth System Model Simulations ocean / K. M. Krumhardt [et al.] // Journal of Advances inModeling Earth Systems. 2019. Vol. 11, iss. 5. P. 1418–1437.https://doi.org/10.1029/2018MS001483
7. Apparent increase in coccolithophore abundance in the subtropical North Atlantic from 1990to 2014 / K. M. Krumhardt [et al.] // Biogeosciences. 2016. Vol. 13, iss. 4. P. 1163–1177.https://doi.org/10.5194/bg-13-1163-2016
8. Poleward expansion of the coccolithophore Emiliania huxleyi / A. Winter [et al.] // Journal ofPlankton Research. 2014. Vol. 36, iss. 2. P. 316–325. https://doi.org/10.1093/plankt/fbt110
9. Pan genome of the phytoplankton Emiliania underpins its global distribution / B. Read [et al.] //Nature. 2013. Vol. 499. P. 209–213. https://doi.org/10.1038/nature12221
10. Sedimentation of phytoplankton during a diatom bloom: rates and mechanisms / T. Kiørboe[et al.] // Journal of Marine Research. 1996. Vol. 54, iss. 6. P. 1123–1148.https://doi.org/10.1357/0022240963213754
11. Smayda T. J. What is a bloom? A commentary // Limnology and Oceanography. 1997. Vol. 42,iss. 5. P. 1132–1136. https://doi.org/10.4319/lo.1997.42.5_part_2.1132
12. Toxic and Harmful Microalgae of the World Ocean / P. Lassus [et al.]. Nantes : InternationalSociety for the Study of Harmful Algae/Intergovernmental Oceanographic Commission ofUNESCO, 2016. 523 p. (IOC manuals and Guides ; vol. 68).
13. Nutrient enrichment alters phytoplankton biomass and composition via silicon limitation /K. Makareviciute-Fichtner [et al.] // Frontiers in Marine Science. 2024. Vol. 11. 1289768.https://doi.org/10.3389/fmars.2024.1289768
14. Richardson K. Harmful or Exceptional Phytoplankton Blooms in the Marine Ecosystem // Ad-vances in Marine Biology. 1997. Vol. 31. P. 301–385. https://doi.org/10.1016/S0065-2881(08)60225-4
15. Kahru M., Nommann S. The phytoplankton spring bloom in the Baltic Sea in 1985, 1986: Mul-titude of spatiotemporal scales // Continental Shelf Research. 1990. Vol. 10, iss. 4. P. 329–354.https://doi.org/10.1016/0278-4343(90)90055-Q
16. Carstensen J., Henriksen P., Heiskanen A.-S. Summer algal blooms in shallow estuaries: Defi-nition, mechanisms, and link to eutrophication // Limnology and Oceanography. 2007. Vol. 52,iss. 1. P. 370–384. https://doi.org/10.4319/lo.2007.52.1.0370
17. Paerl H. W. Nuisance phytoplankton blooms in coastal, estuarine and inland waters // Limnol-ogy and Oceanography. 1988. Vol. 33, iss. 4, part 2. P. 823–843.https://doi.org/10.4319/lo.1988.33.4part2.0823
18. Margalef R. Life-forms of phytoplankton as survival alternatives in an unstable environment //Oceanologica Acta. 1978. Vol. 1, iss. 4. P. 493–509
19. Isles P. D., Pomati F. An operational framework for defining and forecasting phytoplankton blooms // Frontiers in Ecology and the Environment. 2021. Vol. 19, iss. 8. P. 443–450. https://doi.org./10.1002/fee.2376
20. Berseneva G., Churilova T., Georgieva L. Seasonal variability in pigment concentration, taxo-nomic structure of phytoplankton community in western part of the Black Sea // Oceanology. 2004. Vol. 44, iss. 3. P. 362–371. https://doi.org/10.1594/PANGAEA.762833
21. Pautova L. A., Mikaelyan A. S., Silkin V. A. Structure of plankton phytocoenoses in the shelf waters of the northeastern Black Sea during the Emiliania huxleyi bloom in 2002-2005 // Ocean-ology. 2007. Vol. 47, iss. 3. P. 408–417. https://doi.org/10.1134/S0001437007030101
22. Phytoplankton blooms in Black Sea and Mediterranean coastal ecosystems subjected to anthro-pogenic eutrophication: similarities and differences / S. Moncheva [et al.] // Estuarine Coastal and Shelf Science. 2001. Vol. 53, iss. 3. P. 281–295. https://doi.org/10.1006/ecss.2001.0767
23. Stramski D., Kiefer D. A. Light scattering by microorganisms in the open ocean // Progress in Oceanography. 1991. Vol. 28, iss. 4. P. 343–383. https://doi.org/10.1016/0079-6611(91)90032-h
24. Cokacar T., Oguz T., Kubilay N. Satellite-detected early summer coccolithophore blooms and their interannual variability in the Black Sea // Deep Sea Research Part I: Oceanographic Re-search Papers. 2004. Vol. 51, iss. 8. P. 1017–1031. https://doi.org/10.1016/j.dsr.2004.03.007
25. Satellite monitoring of coccolithophore blooms in the Black Sea from ocean color data / O. Ko-pelevich [et al.] // Remote Sensing of Environment. 2014. Vol. 146. P. 113–123. https://doi.org/10.1016/j.rse.2013.09.009
26. Kubryakov A. A., Mikaelyan A. S., Stanichny S. V. Summer and winter coccolithophore blooms in the Black Sea and their impact on production of dissolved organic matter from Bio-Argo data // Journal of Marine Systems. 2019. Vol. 199. 103220. https://doi.org/10.1016/j.jmarsys.2019.103220
27. Regional algorithm for estimating high coccolithophore concentration in the northeastern part of the Black Sea / S. Vazyulya [et al.] // Remote Sensing. 2023. Vol. 15, iss. 9. 2219. https://doi.org/10.3390/rs15092219
28. Cazzaniga I., Zibordi G., Mélin F. Spectral variations of the remote sensing reflectance during coccolithophore blooms in the Western Black Sea // Remote Sensing of Environment. 2021. Vol. 264. 112607. https://doi.org/10.1016/j.rse.2021.112607
29. The Black Sea IOPs based on SeaWiFS data / V. Suslin [et al.] // Proceedings of SPIE. Tomsk, 2016. Vol. 10035 : XXII International Symposium «Atmospheric and Ocean Optics: Atmos-pheric Physics». 1003531. https://doi.org/10.1117/12.2248332
30. Suslin V., Churilova T. A regional algorithm for separating light absorption by chlorophyll-a and coloured detrital matter in the Black Sea, using 480–560 nm bands from ocean colour scan-ners // International Journal of Remote Sensing. 2016. Vol. 37, iss. 18. P. 4380–4400. https://doi.org/10.1080/01431161.216.1211350
31. Churilova T. Ya., Suslin V. V. O prichinah dominirovaniya Emiliania huxleyi v fitoplank-tone glubokovodnoy chasti Chernogo morya v nachale leta // Ekologicheskaya bezopasnost' pribrezhnoy i shel'fovoy zon i kompleksnoe ispol'zovanie resursov shel'fa. Sevasto-pol', 2012. Vyp. 26, t. 2. S. 195–203. EDN VWSEIL.
32. Dorofeev V. L. Modeling of decadal variations in the Black-Sea ecosystem // Physical Ocean-ography. 2009. Vol. 19, iss. 6. P. 400–409. https://doi.org/10.1007/s11110-010-9062-6
33. Ivanov V. A., Belokopytov V. N. Okeanografiya Chernogo morya. Sevastopol' : NAN Ukra-iny, Morskoy gidrofizicheskiy institut, 2011. 212 s. EDN XPERZR.
34. Suslin V. V., Churilova T. Ya. Uproschennyy metod rascheta spektral'nogo diffuznogo ko-efficienta oslableniya sveta v verhnem sloe Chernogo morya na osnove sputnikovyh dan-nyh // Ekologicheskaya bezopasnost' pribrezhnoy i shel'fovoy zon i kompleksnoe ispol'-zovanie resursov shel'fa. Sevastopol', 2010. Vyp. 22. S. 47–60. EDN WTBHRN.
35. Behrenfeld M. J. Abandoning Sverdrup's Critical Depth Hypothesis on phytoplankton blooms // Ecology. 2010. Vol. 91, iss. 4. P. 977–989. https://doi.org/10.1890/09-1207.1
36. The onset of the spring phytoplankton bloom in the coastal North Sea supports the DisturbanceRecovery Hypothesis / R. González-Gil [et al.] // Biogeosciences. 2022. Vol. 19, iss. 9. P. 2417–2426. https://doi.org/10.5194/bg-19-2417-2022
37. Photoacclimation of photosynthesis irradiance response curves and photosynthetic pigments inmicroalgae and cyanobacteria / H. L. MacIntyre [et al.] // Journal of Phycology. 2002. Vol. 38,iss. 1. P. 17–38. https://doi.org/10.1046/j.1529-8817.2002.00094.x
38. Primary productivity and biogeochemical cycles in the sea / Ed. P. G. Falkowski, A. D. Wood-head, K. Vivirito. New York : Springer, 1992. 550 p. https://doi.org/10.1007/978-1-4899-0762-2
39. Falkowski P. G., Raven J. A. Aquatic photosynthesis. New Jersey : Princeton University Press,2007. 488 p. https://doi.org/10.1515/9781400849727
40. Richardson K., Beardall J., Raven J. A. Adaptation of unicellular algae to irradiance: an analy-sis of strategies // New Phytologist. 1983. Vol. 93. P. 157–191. https://doi.org/10.1111/J.1469-8137.1983.TB03422.X
41. Cell and growth characteristics of types A and B of Emiliania huxleyi (Prymnesiophyceae) asdetermined by flow cytometry and chemical analyses / J. D. van Bleijswijk [et al.] // Journal ofPhycology. 1994. Vol. 30, iss. 2. P. 230–241. https://doi.org/10.1111/j.0022-3646.1994.00230.x
42. Nielsen M. V. Growth, dark respiration and photosynthetic parameters of the coccolithophoridEmiliania huxleyi (Prymnesiophyceae) acclimated to different day length-irradiance combina-tions // Journal of Phycology. 1997. Vol. 33, iss. 5. P. 818–822. https://doi.org/10.1111/j.0022-3646.1997.00818.x
43. The trade‐off between the light‐harvesting and photoprotective functions of fucoxanthin‐chlo-rophyll proteins dominates light acclimation in Emiliania huxleyi (clone CCMP 1516) /B. A. McKew [et al.] // New Phytologist. 2013. Vol. 200, iss. 1. P. 74–85.https://doi.org/10.1111/nph.12373
44. Paasche E. A review of the coccolithophorid Emilinia huxleyi (Prymnesiophyceae) with par-ticular reference to growth, coccolith formation, and calcification–photosynthesis interactions //Phycologia. 2002. Vol. 40, iss. 6. P. 503–529. https://doi.org/10.2216/i0031-8884-40-6-503.1
45. Gafar, N. A., Schulz K. G. A three-dimensional niche comparison of Emiliania huxleyi andGephyrocapsa oceanica: reconciling observations with projections // Biogeosciences. 2018.Vol. 15, iss. 11. P. 3541–3560. https://doi.org/10.5194/bg-15-3541-2018
46. Raven J. A. The cost of photoinhibition // Physiologia Plantarum. 2011. Vol. 142, iss. 1. P. 87–104. https://doi org/10.1111/j.1399-3054.2011.01465.x
47. Neumann G., Pierson W. J. Principles of physical oceanography. Englewood Cliffs : Prentice-Hall, 1966. P. 230–233.
48. Photosynthetically available radiation on surface of the Black Sea based on ocean color data /V. V. Suslin [et al.] // Proceedings of SPIE. Tomsk, 2015. Vol. 9680 : 21st International Sym-posium Atmospheric and Ocean Optics: Atmospheric Physics. 96800T.https://doi.org/10.1117/12.2203660
49. Koncentraciya hlorofilla «a» i pogloschenie sveta okrashennym rastvorennym organi-cheskim veschestvom v chernom more zimoy (2018) i letom (2020) / T. Ya. Churilova [i dr.] //Fundamental'naya i prikladnaya gidrofizika. 2024. № 3 (v pechati).
50. Napp J. M., Hunt G. L. J. Anomalous conditions in the south-eastern Bering Sea 1997: linkagesamong climate, weather, ocean and biology // Fish Oceanography. 2001. Vol. 10, iss. 1. P. 61–68.https://doi.org/10.1046/j.1365-2419.2001.00155.x
51. Ecology of coccolithophores in the Indian sector of the Southern Ocean / R. Mohan [et al.] //Marine Micropaleontology. 2008. Vol. 67, iss. 1–2. P. 30–45. https://doi.org/10.1016/j.marmi-cro.2007.08.005
52. Calcite production by coccolithophores in the south east Pacific Ocean / L. Beaufort [et al.] //Biogeosciences. 2008. Vol. 5, iss. 4. P. 1101–1117. https://doi.org/10.5194/bg-5-1101-2008
53. O’Brien, C. J., Vogt M., Gruber N. Global coccolithophore diversity: Drivers and future change // Pro-gress in Oceanography. 2016. Vol. 140. P. 27–42. https://doi.org/10.1016/j.pocean.2015.10.003
54. Oguz T., Merico A. Factors controlling the summer Emiliania huxleyi bloom in the Black Sea:A modeling study // Journal of Marine Systems. 2006. Vol. 59, iss. 3–4. P. 173–188.https://doi.org/10.1016/j.jmarsys.2005.08.002
55. Nanninga H., Tyrrell T. Importance of light for the formation of algal blooms by Emilianiahuxleyi // Marine Ecology Progress Series. 1996. Vol. 136. P. 195–203.https://doi.org/10.3354/meps136195
56. Karabashev G. S., Sheberstov S. V., Yakubenko V. G. Iyun'skiy maksimum normalizovan-noy yarkosti i ego svyaz' s gidrologicheskimi usloviyami i cveteniem kokkolitoforidv Chernom more // Okeanologiya. 2006. T. 46, № 3. S. 331–343. EDN HUBJRF.
57. Summer Blooming of Coccolithophorids in the Northeastern Black Sea / A. S. Mikaelyan[et al.] // Oceanology. 2005. Vol. 45. P. S127–S138.
58. Geider R. J., Macintyre H. L., Kana T. Dynamic model of phytoplankton growth and acclima-tion: Responses of the balanced growth rate and the chlorophyll a:carbon ratio to light, nutrient-limitation and temperature // Marine Ecology Progress Series. 1997. Vol. 148, iss. 1–3. P. 187–200. https://doi.org/10.3354/meps148187
59. Iron limits primary productivity during spring bloom development in the central North Atlan-tic / C. M. Moore [et al.] // Global Change Biology. 2006. Vol. 12, iss. 4. P. 626–634. https://doi.org/10.1111/j.1365-2486.2006.01122.x
60. Cullen J. J., Yang X., MacIntyre H. L. Nutrient limitation of marine photosynthesis // PrimaryProductivity and Biogeochemical Cycles in the Sea / Ed. P. G. Falkowski, A. V. Woodhead.NY : Plenum Press, 1992. P. 69–88. https://doi.org /10.1007/978-1-4899-0762-2_5
61. Reigman R., Noordeloos A. A. M., Cadee G. C. Phaeocystis blooms and eutrophication of thecontinental coastal zones of the North Sea // Marine Biology. 1992. Vol. 112, iss. 3. P. 479–484. https://doi.org/10.1007/BF00356293
62. Egge J. K., Heimdal B. R. Blooms of phytoplankton including Emiliania huxleyi (Haptophyta).Effects of nutrient supply in different N:P ratios // Sarsia. 1994. Vol. 79, iss. 4. P. 333–348.https://doi.org/10.1080/00364827.1994.10413565
63. Tyrrell T., Taylor A. H. A modelling study of Emiliania huxleyi in the NE Atlantic // Journal ofMarine Systems. 1996. Vol. 9, iss. 1–2. P. 83–112. https://doi.org/10.1016/0924-7963(96)00019-x
64. Krivenko O. V. Soderzhanie i potreblenie neorganicheskih soedineniy azota v Chernommore // Morskoy ekologicheskiy zhurnal. 2008. T. 7, № 4. S. 13–26. EDN TYNYTZ.
65. Krivenko O. V. Osnovnye zakonomernosti formirovaniya «novoy» i regeneracionnoyprodukcii v Chernom more // Morskoy gidrofizicheskiy zhurnal. 2006. № 6. S. 29–43.EDN YOFQSD.
66. Krivenko O. V., Parhomenko A. V. Voshodyaschiy i regeneracionnyy potoki neorganiche-skih soedineniy azota i fosfora v glubokovodnoy oblasti Chernogo morya // Zhurnal ob-schey biologii. 2014. T. 75, № 5. S. 394–408. EDN SNHZID.
67. Coccolithophore ecology in the tropical and subtropical Atlantic Ocean: new perspectives fromthe Atlantic meridional transect (AMT) programme / A. J. Poulton [et al.] // Progress in Ocean-ography. 2017. Vol. 158. P. 150–170. https://doi.org/10.1016/j.pocean.2017.01.003
68. Godrijan J., Drapeau D. T., Balch W. M. Osmotrophy of dissolved organic carbon by cocco-lithophores in darkness // New Phytologist. 2022. Vol. 233, iss. 2. P. 781–794.https://doi.org/10.1111/nph.17819
69. The possession of coccoliths fails to deter microzooplankton grazers / K. M. J. Mayers [et al.] //Frontiers in Marine Science. 2020. Vol. 7. 569896. https://doi.org/10.3389/fmars.2020.569896
70. Pitanie massovyh vidov rastitel'noyadnogo planktona chernogo morya i ih rol' v potreb-lenii kokkolitoforid / A. B. Amelina [i dr.] // Okeanologiya. 2017. T. 57, № 6. S. 894–905. EDN ZVRIBH
71. Greze V. N., Fedorina A. I. Chislennost' i biomassa zooplanktona // Osnovy biologicheskoy produktivnosti Chernogo morya / pod red. V. N. Greze. Kiev : Naukova dumka, 1979. S. 157–164.
72. Mnogoletnyaya dinamika mezozooplanktona v Sevastopol'skoy buhte (1976-1996) na pri-mere Copepoda / A. D. Gubanova [i dr.] // Okeanologiya. 2002. T. 42, № 4. S. 537–545.
73. Rost B., Riebesell U. Coccolithophores and the biological pump: responses to environmental changes //Coccolithophores: from molecular processes to global impact / Ed. H. R. Thierstein, J. R. Young. Hei-delberg ; Berlin : Springer, 2004. P. 99–125. https://doi.org/10.1007/978-3-662-06278-4_5
74. Müller M. N. On the genesis and function of coccolithophore calcification // Frontiers in MarineScience. 2019. Vol. 6. 49. https://doi.org/10.3389/fmars.2019.00049
75. Influence of the calcium carbonate shell of coccolithophores on ingestion and growth of a di-noflagellate predator / M. Haunost [et al.] // Frontiers in Marine Science. 2021. Vol. 8. 664269.https://doi.org/10.3389/fmars.2021.664269
76. Why marine phytoplankton calcify / F. M. Monteiro [et al.] // Science Advances. 2016. Vol. 2,iss. 7. e1501822. https://doi.org/10.1126/sciadv.1501822
77. Nelson N. B., Siegel D. A. The Global distribution and dynamics of chromophoric dissolvedorganic matter // Annual Review of Marine Science. 2013. Vol. 5, iss. 1. P. 447–476.https://doi.org/10.1146/annurev-marine-120710-100751
78. State of the Environment of the Black Sea (2001 - 2006/7) / Ed. T. Oguz. Istanbul : Commissionon the Protection of the Black Sea Against Pollution, 2008. 488 p.
79. Tozzi S., Schofield O., Falkowski P. Historical climate change and ocean turbulence as selectiveagents for two key phytoplankton functional groups // Marine Ecology Progress Series. 2004.Vol. 274. P. 123–132. https://doi.org/10.3354/meps274123
80. Estrada M., Alcaraz M., Marrase C. Effects of turbulence on the composition of phytoplanktonassemblages in marine microcosms // Marine Ecology Progress Series. 1987. Vol. 38, iss. 3.P. 267–281. https://doi.org/10.3354/meps038267
81. Why is the land green and the ocean red? // Coccolithophores: from molecular processes toglobal impact / P. Falkowski [et al.] / Ed. H. R. Thierstein, J. R. Young. Heidelberg ; Berlin :Springer, 2004. P. 429–453. https://doi.org/10.1007/978-3-662-06278-4_16
82. New Evidence for Morphological and Genetic Variation in the Cosmopolitan CoccolithophoreEmiliania Huxleyi (Prymnesiophyceae) from the Cox1b-Atp4 Genes / K. Hagino [et al.] // Jour-nal of Phycology. 2011. Vol. 47, iss. 5. P. 1164–1176. https://doi.org/10.1111/j.1529-8817.2011.01053.x
83. Rapid diversification underlying the global dominance of a cosmopolitan phytoplankton / E. M. Bendif [et al.] // ISME Journal. 2023. Vol. 17, iss. 4. P. 630–640. https://doi.org/10.1038/s41396-023-01365-5
84. Wheeler G. L., Sturm D., Langer G. Gephyrocapsa huxleyi (Emiliania huxleyi) as a model sys-tem for coccolithophore biology // Journal of Phycology Journal of Phycology. 2023. Vol. 59,iss. 6. P. 1123–1129. https://doi.org/10.1111/jpy.13404


















