Sevastopol, Russian Federation
Russian Federation
The paper studies toxicity of drilling and cementing fluids, used in offshore oil and gas op- erations, at concentrations of 10, 50, 100, 500 and 1000 mg/L for the mass species of ben- thic marine communities in the coastal part of the Black Sea: the eelgrass Nanozostera noltii and the amphipod Chaetogammarus olivii. The paper analyses effect of these toxic mixtures on the increase in biomass, leaves and roots of the eelgrass and on the survival of amphipods after 10, 20 and 30 days of exposure. Drilling fluid was shown to be more toxic than cementing fluid for the test organisms. Exposure to 10 mg/L of drilling fluid reduced the plant biomass growth by 49% after 10 days and by 62 and 78% after 20 and 30 days, respectively. With increase in the drilling fluid concentration to 50–100 mg/L, this indicator continued to decline rapidly to 60–80% relative to the control, and at a concentration of 500–1000 mg/L, the plants died. The roots of eelgrass were more sensitive to the toxicant than the leaves: the root growth showed a marked tendency to decrease by 48% relative to the control at toxicant concentrations of 50–100 mg/L after only 10 days. The harmful effect of the cementing fluid on the eelgrass was less pronounced than that of the drilling fluid. Exposed to the cementing fluid, the plants died at the highest concentration of the toxicant (1000 mg/L) after 30 days. No significant differences were found between the leaf growth in the test and control variants, but the root growth decreased significantly by 64 and 90% at 10 and 20 days at cementing fluid concentrations of 500 and 1000 mg/L, re- spectively. Throughout the experiment, the survival rate of the crustaceans exposed to over 10 mg/L drilling fluid was significantly lower than the control (30–85%). During exposure to the cementing fluid, however, significant differences were observed only at the highest concentration of 1000 mg/L. An ecotoxicological assessment of substances used in oil well drilling is necessary to determine their hazard when used in oil and gas production, as well as to select optimal components in their composition that contribute to reducing environ- mental damage to benthic marine communities.
Black Sea, oil and gas complex, pollution, amphipods, Zostera, bioassay
Введение
Работа нефтегазового комплекса на шельфе морей и океанов неизбежно сопровождается попаданием продуктов этой деятельности в окружающую среду, а его стремительное развитие существенно усиливает это воздействие. Прибрежные зоны отличаются наивысшей биологической продуктивностью и интенсивно эксплуатируются людьми для рыболовства, аквакультуры, от- дыха, спорта, судоходства и добычи полезных ископаемых. Антропогенная нагрузка на эти акватории максимальна и разнопланова, что негативно отра- жается на природных комплексах, приводит к их трансформации и деграда- ции с полной потерей ресурсов или невозможностью их использования вследствие загрязнения поллютантами и гибели гидробионтов. Для анализа подобных пагубных процессов и поиска способов их предотвращения ис- пользуются экотоксикологические методы, которые в природных и лабора- торных условиях позволяют оценить последствия попадания в морскую среду чужеродных соединений антропогенного происхождения, выявлять их воз- действие на природные объекты с целью изучения поведения загрязняющих веществ, их допустимых уровней и влияния на морскую биоту.
Разработки нефти и газа на шельфе сопровождаются выбросом в мор- скую среду не только нефти и ее производных, но и буровых растворов (БР) и других компонентов, используемых при строительстве скважин. БР – это сложные смеси, состоящие из воды, суспензий, эмульгаторов, аэрированных жидкостей, органических растворителей, тяжелых металлов и глины, которые используются для промывки скважин при бурении [1, 2]. После использова- ния БР попадают в категорию промышленных отходов и должны быть утили- зированы, поскольку многие из них являются токсичными, обладают мута- генными и канцерогенными свойствами. Кроме того, при бурении использу- ются специальные тампонажные жидкости (ТЖ), основное назначение кото- рых заключается в цементировании скважин. Они также имеют сложный со- став и включают опасные и токсичные вещества [3, 4]. Следует ожидать уве- личения объемов поступления этих компонентов в морскую среду, так как если в 2020 г. было пробурено 39 000 скважин, то в 2022 г. их число увеличи- лось до 49 600, а к 2026 г. их количество может возрасти до 60 000 [5].
При разливах нефти в основном страдают поверхностные воды и их оби- татели, тогда как при выбросах БР – бентосные сообщества. При этом ин- формация о загрязнении морской среды и гидробионтов БР и другими веще- ствами, используемыми при буровых работах, крайне ограниченна и неодно- значна [6, 7], а эффекты могут существенно различаться у представителей разных таксономических групп [8, 9].
Макрофиты и высшая водная растительность, которая в прибрежных дон- ных биоценозах в основном представлена зостерой, являются наиболее уяз- вимым звеном при проведении буровых работ [10]. Это уникальная группа растений, широко распространенная в морях и океанах. Их сообщества играют важнейшую роль в структуре и функционировании прибрежных экосистем, так как служат кормом и убежищем для многих морских обитателей, в том числе имеющих промысловое значение. Зостера характеризуется высокой продуктивностью [11, 12] и вместе с другими морскими макрофитами участ- вует в утилизации биогенов, включая углерод, что имеет важное значение в биосферном обмене и биогеохимических циклах этих элементов. Экосисте- мы морских водорослей и трав поддерживают пастбищные, детритные и пи- щевые сети, стабилизируют осадочные отложения и важны в глобальном круговороте углерода и питательных веществ. Многие виды флоры и фауны обитают в этих экосистемах, образуя сложные пищевые сети [12]. Было под- считано, что годовая экологическая ценность одного акра морского дна, по- крытого водорослями и травами, составляет от $9000 до 28 000. Биоценозы водной растительности выполняют множество экосистемных функций, та- ких как защита от штормов, обеспечение питания промысловых видов рыб и беспозвоночных, круговорот питательных веществ и углерода, что важно в настоящее время для понимания современного состояния цикла биогенных элементов в биосфере [13, 14]. В то же время сообщества зостеры подверга- ются интенсивному антропогенному воздействию, в частности со стороны нефтегазового комплекса, в результате загрязнения среды нефтью, дисперген- тами, БР и содержащимися в их составе тяжелыми металлами [15–18]. Расте- ние поглощает и накапливает компоненты, входящие в состав этих веществ, в связи с чем является хорошим фиторемедиатором и индикатором загрязнен- ных вод. Зостера широко используется в экотоксикологических исследованиях для анализа накопления и токсичности различных загрязнителей, поэтому информация о разнокачественных эффектах необходима для оценки состояния среды ее обитания и разработки критериев предельно допустимых доз [16].
Однако интенсивная антропогенная деятельность крайне негативно влия- ет на зостеру [19]. Способность растения к активному накоплению загрязни- телей позволяет использовать его в качестве биоиндикатора для экологиче- ской оценки состояния прибрежных зон моря, а также при разработке тест- систем для анализа токсичности вредных веществ. При этом следует прини- мать во внимание концентрации токсикантов, которые могут вызывать неод- нозначные эффекты, что было показано на примере нефтяного загрязнения в работе [20].
Амфиподы широко распространены в прибрежной зоне и занимают до- минирующее положение в составе бентосных сообществ, включая заросли зостеры. Они используются в экотоксикологических исследованиях, так как хорошо живут в лабораторных условиях и реагируют на наличие загрязните- лей. Поскольку личиночные стадии отсутствуют, то в качестве тест-объектов используются как ювенильные, так и взрослые половозрелые особи ракооб- разных [21, 22].
Целью работы является исследование токсичности БР на водной основе и ТЖ, применяемой при цементировании скважин, для типичных массовых видов бентосных организмов прибрежной части Черного моря – морского растения зостеры Nanozostera noltii (Hornemann) и амфипод, обитающих в зарослях этого растения, Chaetogammarus olivii (H. Milne Edwards, 1830). Исследование направлено на изучение влияния стресса, вызванного наличием в среде БР и ТЖ, используемых при добыче нефти и газа, на показатели вы- живаемости, роста и развития гидробионтов с целью сравнения токсичности этих веществ по реакциям тест-организмов сообщества морской травы и ра- кообразных.
Материал и методика
БР представляет собой вязкую жидкость светло-коричневого цвета с за- пахом аммиака, рН в диапазоне 10–11, температурой кипения, превышающей 100 °С, относительной плотностью при 20 °С, равной 1.1–2.0. БР смешивает- ся с водой. В состав вещества входят хлорид натрия, кремнезем и другие до- бавки. Вещество стабильно в нормальных условиях. ТЖ (раствор для цемен- тирования скважин) в основном состоит из сухой цементной смеси, пенога- сителя, пропиленгликоля, соединений кальция и других добавок.
Зостеру и амфипод собирали в прибрежной части б. Казачьей (район Се- вастополя) и немедленно доставляли в лабораторию. Растения отмывали от загрязнений и эпифитной флоры, адаптировали к условиям эксперимента в морской воде в течение 3 сут при температуре 22 ± 2 °С. Токсикологиче- ские эксперименты проводили в соответствии с рекомендациями 1).
Однолетние вегетативные побеги зостеры средней массой 328.5 ± 56 мг помещали в стеклянные емкости объемом 1.5 л по три растения в каждую (рабочий объем составлял 1 л), выдерживали при температуре 22 ± 2 °С и при постоянном искусственном освещении 1500 лк. Взрослых половозрелых ам- фипод помещали в аквариумы объемом 500 мл по 10 экземпляров в каждый и адаптировали к условиям эксперимента в течение недели при естественном освещении (продолжительность светового дня 12 ч) и температуре 22 ± 2 °С. Опыты проводили в трехкратной повторности в течение 30 сут.
Растворы веществ в концентрациях 10, 50, 100, 500 и 1000 мг/л добавля- ли непосредственно в воду. Контролем служила природная морская вода со- леностью 18 ‰ без добавления веществ. Воду меняли через каждые 5–7 сут. Анализировали прирост биомассы растений, их листьев и корней через каж- дые 10 сут. Влияние токсикантов на ракообразных оценивали по их гибели через каждые 10 сут в течение 30 сут. В процессе эксперимента гаммарусов кормили измельченными бурыми водорослями и сушеными дафниями.
Результаты обрабатывали статистически, вычисляли среднее значение M, ошибку среднего m. Сравнение результатов проводили с помощью критерия Стьюдента при уровне значимости р < 0.05. Корреляцию между концентра- цией токсикантов и показателями выживаемости амфипод осуществляли с помощью компьютерной программы CURVEFIT (версия 2.10-L).
1) Об утверждении Методических указаний по разработке нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения : приказ Росрыболовства № 695 от 04.08.09 г.
Результаты
Результаты исследований позволили установить закономерности и осо- бенности влияния токсикантов на исследуемые виды-индикаторы бентосных систем. Было обнаружено неоднозначное действие веществ на рост и разви- тие зостеры при разных концентрациях БР и ТЖ (рис. 1–3). Как можно видеть на рис. 1, уже через 10 сут после начала эксперимента при концентрации БР 50 мг/л и выше произошло достоверное (р < 0.05) снижение прироста био- массы растения по сравнению с контролем. Такой же эффект был отмечен через 20 cут при меньшей концентрации БР – 10 мг/л, а при концентрации 500 и 1000 мг/л растения погибли. Через 30 сут тенденция к снижению прироста биомассы растения по отношению к контролю сохранялась, но различия были

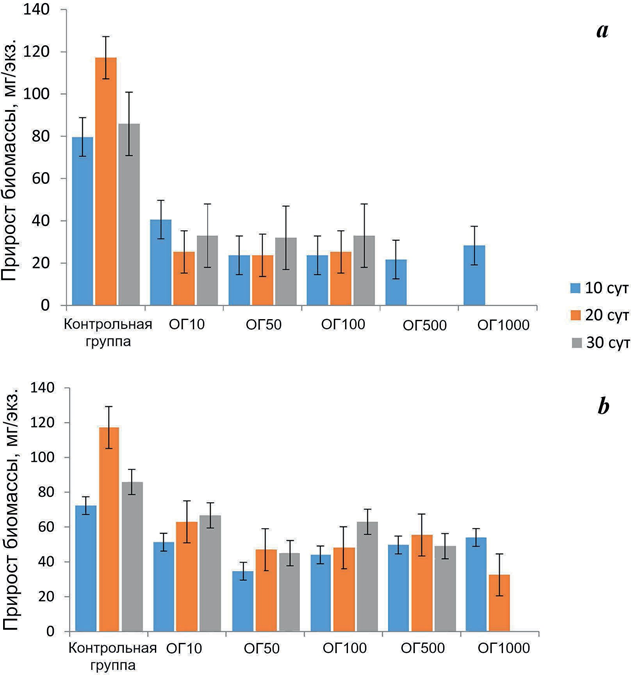
Р ис . 1 . Прирост биомассы зостеры N. noltii (M ± m) при инкубации в среде с буровым раствором (a) и там- понажной жидкостью (b) в концентрации 10 (ОГ10), 50 (ОГ50), 100 (ОГ100), 500 (ОГ500) и 1000 (ОГ1000) мг/л
F ig . 1. Increase in seagrass N. noltii biomass (mg/speci- men, Mean ± SEM) exposed to drilling fluid (a) and ce- menting fluid (b) in concentrations of 10 (ОГ10), 50 (ОГ50), 100 (ОГ100), 500 (ОГ500) and 1000 (ОГ1000) mg/L
недостоверны. Корреляции между концентрацией БР и приростом биомассы зостеры не обнаружено.
При инкубации зостеры в растворах ТЖ с исследуемыми концентрация- ми в течение 10 сут не установлено различий по сравнению с контролем, хотя можно отметить определенную тенденцию к снижению этого показателя. Через 20 сут выявлено достоверное (p < 0.05) уменьшение прироста растения при всех тестируемых концентрациях. Через 30 сут при концентрации 1000 мг/л растения погибли, в остальных опытных группах достоверных различий по отношению к показателям контроля не обнаружено. Корреляции между кон- центрацией токсиканта и приростом биомассы зостеры не выявлено.
Изменение прироста листьев зостеры под влиянием токсикантов приве- дено на рис. 2. БР в исследуемых концентрациях не оказал существенного влияния на прирост листьев растения в течение всего периода эксперимента, но можно отметить тенденцию к снижению этого показателя при больших
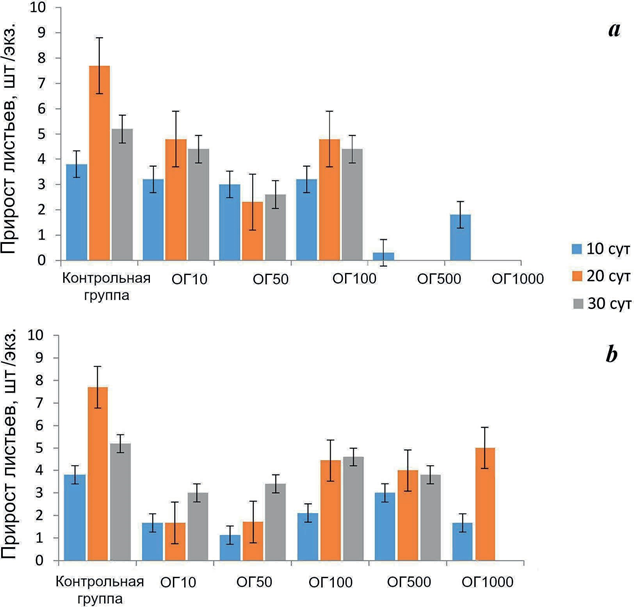
Р ис . 2 . Прирост листьев зостеры N. noltii (M ± m) при инкубации в среде с буровым раствором (а) и тампонажной жидкостью (b) в концентрации 10– 1000 мг/л. Обозначения см. на рис. 1
F ig . 2. Growth of seagrass N. noltii leaves (pcs./specimen, Mean ± SEM) exposed to drilling fluid (a) and cementing fluid (b) in concentrations of 10– 1000 mg/L. Notation: See Fig. 1
(500 и 1000 мг/л) концентрациях токсиканта. При инкубации растения в среде с ТЖ также не было отмечено существенных отличий от контроля через 10 сут после начала эксперимента. Через 20 сут достоверное (p < 0.05) снижение прироста листьев было установлено при низких концентрациях токсиканта (10 и 50 мг/л), при более высоких снижение не отмечено. Через 30 сут разли- чия между контролем и опытными группами не выявлены при всех концен- трациях, за исключением концентрации 1000 мг/л, при которой растения погибли. При воздействии обоих токсикантов не было обнаружено корреля- ционной зависимости между приростом листьев и концентрацией веществ.
На рис. 3 приведены данные о влиянии тестируемых токсикантов на при- рост корней зостеры. Достоверное (p < 0.01) снижение прироста корней рас- тения, инкубированного в БР, произошло при концентрации 500–1000 мг/л
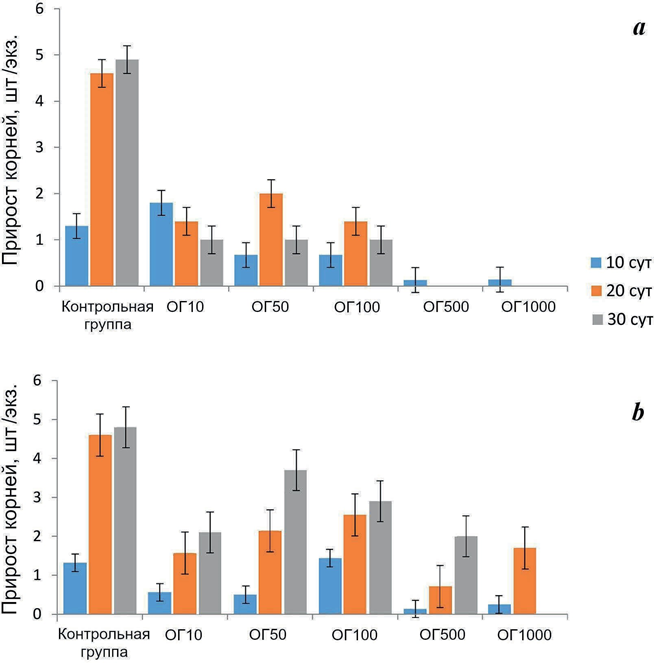

F i g. 3. Growth of seagrass N. noltii roots (pcs./speci- men, Mean ± SEM) exposed to drilling fluid (a) and cement- ing fluid (b) in concentrations of 10–1000 mg/L. Notation: See Fig. 1
уже через 10 сут. Через 20–30 сут такой же эффект наблюдали при более низких концентрациях БР 10 и 50 мг/л. Через 10 сут установлена умеренная корреляция между приростом корней растения и концентрацией токсиканта (Y = 610 − 420.9X, r = 0.490, R2 = 0.37).
При инкубации зостеры в среде с разными концентрациями ТЖ через 10 сут обнаружено достоверное (p < 0.01) снижение прироста корней при кон- центрациях 500 и 1000 мг/л, через 20 и 30 сут был отмечен тот же эффект, но в последнем случае при концентрации 1000 мг/л растение погибло. Следу- ет отметить умеренную корреляцию между приростом корней и концентра- цией токсиканта через 10 сут (Y = 0.94 ̶ X, r = 0.39, R2 = 0.23).
На рис. 4 представлены данные по выживаемости амфипод, экспонируе- мых в БР и ТЖ. Достоверное (p < 0.05) снижение выживаемости ракообраз- ных было отмечено через 10 сут при концентрации БР 50 мг/л. Через 20 сут экспозиции в среде с БР достоверное (p < 0.05) снижение выживаемости ра- ков было выявлено при концентрации 100 мг/л и выше. При этом установле- на высокая корреляция между выживаемостью амфипод и концентрацией БР


Р ис . 4 . Выживаемость амфипод Ch. olivii (M ± m) при инкубации в среде с буровым раствором (а) и тампонаж- ной жидкостью (b) в концентрации 10–1000 мг/л. Обозна- чения см. на рис. 1
F ig . 4. Survival of amphipods (%, Mean ± SEM) exposed to drilling fluid (a) and cementing fluid (b) in concentrations of 10–1000 mg/L. Notation: See Fig. 1
(Y = 54.4 − 0.05X, r = 0.87, R2 = 0.89). Через 30 сут в опытных группах с БР тен- денция сохранилась, но корреляция была более слабой (Y = 41.9 − 0.04X, r = 0.48, R2 = 0.59). При содержании гаммарусов в растворах с разными концентраци- ями ТЖ достоверное снижение выживаемости обнаружено при концентрации 1000 мг/л во все исследуемые периоды, но не установлено взаимосвязи меж- ду их выживаемостью и концентрацией токсиканта.
Обсуждение результатов исследований
Результаты исследований продемонстрировали токсическое действие те- стируемых веществ на типичных представителей донного сообщества зостеру и ракообразных. Наблюдаемые эффекты зависели от концентрации и времени воздействия токсикантов, что позволило сделать предположение как о меха- низмах токсичности веществ, так и возможных последствиях для исследуе- мых организмов бентосного сообщества.
Наши исследования показали, что прирост биомассы зостеры, инкубиро- ванной в среде с добавлением БР, уже через 10 сут после начала эксперимента при концентрации БР 10 мг/л снизился на 49 %. При продолжающемся воз- действии снижение этого показателя при данной концентрации БР составило 62–78 %. При более высоких концентрациях (50–100 мг/л) прирост биомассы продолжал интенсивно снижаться (на 60–80 % по отношению к контролю), а при концентрации 500–1000 мг/л растения погибли. Другие исследователи также обнаружили снижение продуктивности (по показателям поглощения углерода и скорости роста) морской травы рода Thalassia при 10-суточном воздействии концентраций БР 200 и 1000 мкл/л [17]. Вместе с тем в наших исследованиях не установлено различий между приростом листьев у зостеры, подвергнутой воздействию БР, и контролем, а прирост корней имел выра- женную тенденцию к снижению (на 48 %) по отношению к контролю при концентрациях токсиканта 50–100 мг/л уже через 10 сут. В последующие пе- риоды эта зависимость проявилась при всех тестируемых концентрациях. Следует отметить, что рост корней зостеры зависит от многих факторов, та- ких как почвенный субстрат, наличие кислорода и биогенов, перемешивание водной среды, а также присутствие токсикантов, что было установлено и в наших исследованиях. Таким образом, на воздействие БР разные части рас- тения реагировали по-разному, при этом корни оказались более чувствитель- ными к неблагоприятным воздействиям, чем листья, что согласуется с дан- ными других исследователей [23].
Вредное влияние ТЖ на зостеру было выражено в меньшей степени, чем влияние БР. При воздействии ТЖ растения погибли при самой высокой концентрации токсиканта (1000 мг/л) через 30 сут инкубации. Через 10 сут не установлено различий между значениями прироста биомассы и листьев растения у контроля и исследуемых образцов при всех тестируемых концен- трациях, но прирост корней достоверно уменьшился при концентрациях ТЖ 500–1000 мг/л. В последующие периоды эксперимента прирост листьев не отличался от контроля, тогда как прирост биомассы растения достоверно сократился через 20 сут при концентрации 50 мг/л и выше. Ингибирование прироста корней в период 20–30 сут сохранялось при тех же концентрациях токсиканта, а прирост биомассы через 30 сут не отличался от контроля. Таким
образом, можно отметить разное влияние токсиканта на разные части расте- ния, что было установлено при изучении влияния БР на зостеру. При этом корни оказались более чувствительны к воздействию ТЖ, чем листья, что было отмечено и при воздействии БР.
Было показано, что разные токсины, в том числе питательные вещества и сульфиды в высоких концентрациях, могут быть крайне вредными для жиз- недеятельности и расширения популяции зостеры [19]. При этом разные ча- сти растения могут по-разному реагировать на действие токсикантов, вклю- чая биогенные элементы, что связано с более высоким сродством листьев к аммонию по сравнению с корнями. Отрицательное влияние на прирост биомассы Zostera noltii было обнаружено при концентрации сульфида в воде менее 200 мкмоль/л. В природных условиях расширение участков обитания растения не происходило при концентрациях сульфида более 1000 мкмоль/л, что связано со снижением жизнеспособности корней при контакте их с суль- фидами. Вместе с тем исследователи отмечают, что на урожай T. testudinum в лабораторных и полевых условиях не влияла буровая жидкость после 6- и 12-недельного периода воздействия [24], что еще раз подтверждает необхо- димость исследования разнокачественных эффектов влияния буровых жид- костей на представителей донной флоры.
Влияние БР на зостеру может быть прямым и косвенным. Непрямые эф- фекты бурения и БР обусловлены изменением (ухудшением) среды обитания. При бурении скважин образуется множество взвешенных частиц, которые зна- чительно снижают прозрачность воды, что затрудняет проникновение солнеч- ных лучей. Это ингибирует фотосинтетические реакции растений и угнетает их жизнедеятельность, в том числе эпифитную микрофлору [25]. Когда взвешен- ные частицы оседают на дно, они образуют слой, непроницаемый для поступ- ления питательных веществ к корням зостеры, что особенно ярко проявляется при использовании ТЖ, это было продемонстрировано в наших исследованиях. Таким образом, нарушается обмен между средой и растением. Помимо этого, попадание ксенобиотиков в воду нарушает ее физико-химические свойства, что также отрицательно влияет на жизнедеятельность гидробионтов.
Прямое воздействие БР оказывает токсический эффект вследствие нали- чия в его составе тяжелых металлов и органических соединений, которые накапливаются в растениях и нарушают их жизнедеятельность. В совокупно- сти это проявляется в угнетении роста целого растения и отдельных его ча- стей (листьев и корней, что показано в нашем исследовании), невозможности расселения и репродукции. Кроме того, заросли зостеры могут быть непри- годны для других морских обитателей, которые используют их в качестве мест обитаний, например для ракообразных, рыб, моллюсков.
Так, например, в природных и экспериментальных условиях исследова- тели отмечали изменения в численности бентосных беспозвоночных. Макро- фауна, подвергшаяся воздействию БР или глины, применяемой при цементи- ровании скважин, была существенно обеднена по сравнению с контрольной группой [26]. Наши исследования показали, что ТЖ оказалась менее ток- сична для амфипод, чем БР. На протяжении всего эксперимента выживае- мость ракообразных, экспонированных в растворах с концентрацией более 10 мг/л, была достоверно ниже контроля на 30–85 %, тогда как при инкубации в растворах с ТЖ достоверные различия отмечены только при самой высокой концентрации 1000 мг/л, когда этот показатель оказался на 46 % ниже по срав- нению с контрольной группой. Таким образом, проявление токсического дей- ствия на амфипод было специфичным для ТЖ и БР.
Исследователи отмечают, что в природных условиях некоторые морские травы оказались менее чувствительными к нефти, диспергированным маслам и БР, чем приливно-отливные сообщества (кораллы, губки, иглокожие, ман- гровые заросли, беспозвоночные и моллюски [27]. Интересно отметить, что численность бентосных беспозвоночных резко сокращалась под воздействи- ем БР в лабораторных условиях, но эти эффекты не наблюдались в природ- ной среде. Плотность беспозвоночных в полевых условиях была сходной на контрольных и обработанных БР участках, но значительно ниже наблю- давшейся в контроле, при этом видовое разнообразие в полевых и лаборатор- ных условиях не различалось [23].
Таким образом, продолжающаяся глобальная тенденция к росту нефтега- зовой добычи в прибрежных районах морей и океанов представляет значи- тельную угрозу для бентосных экосистем и их обитателей. Изменение физи- ко-химических свойств воды, увеличение ее мутности и снижение доступно- сти света для гидробионтов может иметь каскадные эффекты для морской экосистемы в целом. Учитывая ключевую роль, которую морские травы и обитающие в них беспозвоночные играют в прибрежных экосистемах, дан- ное исследование подчеркивает уязвимость биоценозов к попаданию БР и их компонентов, особенно на фоне меняющихся условий окружающей среды [28, 29].
Заключение
Длительное воздействие БР и их компонентов не только нарушает мета- болические реакции зостеры, но и вызывает отмирание листьев и деградацию тканей, что может поставить под угрозу общее здоровье и жизнеспособность морской травы. Наши исследования показали, что под воздействием БР уже при концентрации 10 мг/л через 10 сут после начала эксперимента прирост биомассы растения снизился на 49 %. Через 20–30 сут снижение этого пока- зателя при данной концентрации БР составило 62–78 % соответственно. При повышении концентрации до 50–100 мг/л прирост биомассы продолжал интенсивно снижаться до 60–80 % по отношению к контролю, а при концен- трации 500–1000 мг/л растения погибли. Корни зостеры оказались более чув- ствительны к действию токсиканта, чем листья: не установлено различий между приростом листьев у зостеры, подвергнутой воздействию БР, и контро- лем, а прирост корней имел выраженную тенденцию к снижению на 48 % по отношению к контролю при концентрациях токсиканта на 50–100 мг/л уже через 10 сут. Вредное влияние ТЖ на зостеру было выражено в меньшей сте- пени, чем влияние БР. При воздействии ТЖ растения погибли при самой высокой концентрации токсиканта (1000 мг/л) через 30 сут инкубации. Достоверных различий между приростом листьев в опытных и контрольных вариантах не установлено, но прирост корней уже на 10–20-е сут достоверно уменьшился на 64–90 % при концентрациях ТЖ 500–1000 мг/л. Изменения скорости роста морских трав (зостеры) и сокращение числа бентосных беспозвоночных в результате нарушения условий среды обитания, ее фи- зико-химических свойств может привести к необратимым модификациям прибрежных бентосных сообществ в целом. ТЖ оказалась менее токсична для амфипод, чем БР, о чем свидетельствует тот факт, что выживаемость ра- кообразных, экспонированных в растворах БР с концентрацией более 10 мг/л, была достоверно ниже контроля на 30–85 %, тогда как при инкубации в рас- творах с ТЖ достоверные различия отмечены только при самой высокой кон- центрации 1000 мг/л. В связи с этим необходима разработка мер по сохране- нию экосистем и защите их от последствий процессов бурения на шельфе. Тесты на токсичность позволяют оценить биологические отклики и концентра- ции, при которых различные выбросы БР и сбросы бурового шлама будут ока- зывать воздействие на индикаторные виды и тест-объекты. Воздействие вклю- чает изменения как автотрофных, так и гетеротрофных особей/популяций, изменения в компонентах структуры сообщества и в процессах, связанных с потоком энергии в экосистемах морских трав и обитающих в них беспозво- ночных. Экотоксикологические методы позволяют оценить воздействие на окружающую среду на протяжении всего цикла бурения. Этот комплексный подход дает ценную информацию о последствиях буровых работ, способ- ствуя принятию обоснованных решений в соответствии с принципами эколо- гической безопасности, помогает в составлении экологических профилей и оценке воздействия для различных путей управления отходами.
1. Environmental and public health effects of spent drilling fluid: an updated systematic review / M. Antia [et al.] // Journal of Hazardous Materials Advances. 2022. Vol. 7. P. 100–120. https://doi.org/10.1016/j.hazadv.2022.100120
2. Physical and chemical characterization of drill cuttings: A review / L. C. Costa [et al.] // Marine Pollution Bulletin. 2023. Vol. 194, Part A, 115342. https://doi.org/10.1016/ j.marpolbul.2023.115342
3. Toxicity of drilling fluids in aquatic organisms: a review / J. F. Aslan [et al.] // Ecotoxicology Environmental Contamination. 2019. Vol. 14, iss. 1. P. 35–47. https://doi.org/10.5132/eec.2019.01.04
4. Monitoring of drilling fluids and cuttings as an environmental management tool for offshore fluid operations / L. S. Marinho [et al.] // Proceedings of Offshore Technology Conference, Houston, Texas, USA, May 6–9, 2024. OTC, 2024. (OTC-35185-MS).
5. Green drilling fluid additives for a sustainable hole-cleaning performance: a compre- hensive review / H. Mahmoud [et al.] // Emergent Materials. 2024. Vol. 7. P. 387–402. https://doi.org/10.1007/s42247-023-00524-w
6. Stark J. S. Effects of lubricant oil and diesel on macrofaunal communities in marine sediments: A five year field experiment in Antarctica // Environmental Pollution. 2022. Vol. 311. 119885. https://doi.org/10.1016/j.envpol.2022.119885
7. Development of novel inhibitive water-based drilling muds for oil and gas field appli- cations / E. Yalman [et al.] // Journal of Petroleum Science and Engineering. 2022. Vol. 210. 109907. https://doi.org/10.1016/j.petrol.2021.109907
8. Acute toxicity of produced water on selected organisms in the aquatic environment of the Niger delta / O. Temilola [et al.] // Scientific African. 2020. Vol. 8. e00460. https://doi.org/10.1016/j.sciaf.2020.e00460
9. Environmental, health and safety assessment of nanoparticle application in drilling mud – Review / C. A. Martin [et al.] // Geoenergy Science and Engineering. 2023. Vol. 226. 211767. https://doi.org/10.1016/j.geoen.2023.211767
10. The genome of the seagrass Zostera marina reveals angiosperm adaptation to the sea / J. L. Olsen [et al.] // Nature. 2016. Vol. 530. P. 331–335. https://doi.org/10.1038/nature16548
11. Dynamics of a deep-water seagrass population on the Great Barrier Reef: annual occur- rence and response to a major dredging program / P. H. York [et al.] // Scientific Reports. 2015. Vol. 5. 13167. https://doi.org/10.1038/srep13167
12. Review of seagrass bed pollution / Y. Zhang [et al.] // Water. 2023. Vol. 15. 3754. https://doi.org/10.3390/w15213754
13. Lewis M. A., Devereux R. Nonnutrient anthropogenic chemicals in seagrass ecosys- tems: fate and effects // Environmental Toxicology and Chemistry. 2009. Vol. 28, iss. 3. P. 644–661. https://doi.org/10.1897/08-201.1
14. Photosynthetic parameters of the seaweeds widely spread near the Crimean coast / E. F. Vasechkina [et al.] // Regional Studies in Marine Science. 2023. Vol. 66, iss. 15. 103170. https://doi.org/10.1016/j.rsma.2023.103170
15. Impacts of climate change on submerged and emergent wetland plants / F. T. Short [et al.] // Aquatic Botany. 2016. Vol. 135. P. 3–17. https://doi.org/10.1016/J.AQUABOT.2016.06.006
16. Recommendations for improving the reporting and communication of aquatic toxicity studies for oil spill planning, response, and environmental assessment / A. C. Bejarano [et al.] // Aquatic Toxicology. 2023. Vol 255. 106391. https://doi.org/10.1016/ j.aquatox.2022.106391
17. Price W. A., Macauley J. M., Clark J. R. Effects of drilling fluids on Thalassia testudi- num and its epiphytic algae // Environmental Experimental Botany. 1986. Vol. 26, iss. 4. P. 321–330. https://doi.org/10.1016/0098-8472(86)90019-5
18. Interaction of short-term copper pollution and ocean acidification in seagrass ecosystems: toxicity, bioconcentration and dietary transfer / S.I. de los Santos [et al.] // Marine Pollu- tion Bulletin. 2019. Vol. 142. P. 155–163. https://doi.org/10.1016/j.marpolbul.2019.03.034
19. Toxic effects of increased sediment nutrient and organic matter loading on the seagrass Zostera noltii / L. L. Govers [et al.] // Aquatic Toxicology. 2014. Vol. 155. P. 253–260. https://doi.org/10.1016/j.aquatox.2014.07.005
20. Comparative analysis of heavy metal accumulation and bioindication in three seagrasses: Which species is more suitable as a bioindicator? / C. Hu [et al.] // Science of the Total En- vironment. 2019. Vol. 669. P. 41–48. https://doi.org/10.1016/j.scitotenv.2019.02.425
21. Rudneva I. I., Medyankina M. V., Shayda V. G. Ocenka toksichnosti burovyh rastvo- rov dlya morskih bentosnyh rakoobraznyh // Ekosistemy. 2023. T. 34. S. 140–144.
22. Uptake of polycyclic aromatic hydrocarbons via high-energy water accommodated fraction (HEWAF) by beach hoppers (Amphipoda, Talitridae) using different sandy beach exposure pathways / B. M. Duke [et al.] // Marine Pollution Bulletin. 2023. Vol. 190. 114835. https://doi.org/10.1016/j.marpolbul.2023.114835
23. Persistent organic pollutants (POPs) in coastal wetlands: A review of their occurrences, toxic effects, and biogeochemical cycling / L. Girones [et al.] // Marine Pollution Bul- letin. 2021. Vol. 172. 112864. https://doi.org/10.1016/j.marpolbul.2021.112864
24. Weber D. E., Flemer D. A., Bundrick C. M. Comparison of the effects of drilling fluid on macrobenthic invertebrates associated with the seagrass, Thalassia testudinum, in the laboratory and field // Estuarine, Coastal and Shelf Science. 1992. Vol. 35, iss. 3. P. 315–330. https://doi.org/10.1016/S0272-7714(05)80051-4
25. Multi-leveled insights into the response of the eelgrass Zostera marina L to Cu than Cd exposure / Y. Qiao [et al.] // Science of the Total Environment. 2022. Vol. 845. 157057. https://doi.org/10.1016/j.scitotenv.2022.157057
26. Physiological responses of eelgrass (Zostera marina) to ambient stresses such as herbi- cide, insufficient light, and high water temperature / K. Mochida [et al.] // Aquatic Toxicology. 2019. Vol. 208. P. 20–28. https://doi.org/10.1016/j.aquatox.2018.12.018
27. An ecosystem perspective on potential impacts of drilling fluid discharges on seagrass- es / J. R. Kelly [et al.] // Environmental Management. 1987. Vol. 11. P. 537–562. https://doi.org/10.1007/BF01867661
28. Hasler-Sheetal H. Detrimental impact of sulfide on the seagrass Zostera marina in dark hypoxia // PLoS ONE. 2023. Vol. 18, iss. 12. e0295450 https://doi.org/10.1371/ journal.pone.0295450
29. Insights into response of seagrass (Zostera marina) to sulfide exposure at morphologi- cal, physiochemical and molecular levels in context of coastal eutrophication and warming / Y. Zhang [et al.] // Plant, Cell and Environment. 2024. Vol. 47, iss. 12. P. 4768–4785. https://doi.org/10.1111/pce.15048

















